Обмін речовин
| Було запропоновано приєднати статтю Проміжний обмін до цієї статті або розділу, але, можливо, це варто додатково обговорити. Пропозиція із серпня 2019. |
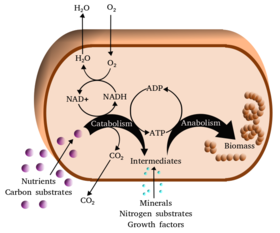
О́бмін речови́н або метаболі́зм — сукупність хімічних реакцій, що відбуваються в живих організмах. Метаболізм поділяється на дві гілки: катаболізм (дисиміляція або енергетичний обмін), що охоплює реакції розщеплення складних органічних речовин до простіших, яке супроводжується їх окисненням і виділенням корисної енергії, та анаболізм (асиміляція або пластичний обмін) — реакції синтезу необхідних клітині речовин, у яких енергія, отримана у катаболічних реакціях, використовується.
| Обмін речовин | |
 | |
| Під впливом | дієтологія[d] |
|---|---|
| | |

| 1. Що таке метаболізм // Канал «Цікава наука» на YouTube, 6 лютого 2020. | |
Майже всі метаболічні реакції пришвидшуються ферментами — каталізаторами білкової природи. Ферменти не тільки роблять можливим швидке протікання у клітині великої кількості реакцій, що за інших умов потребували би дуже високих температур або/і тиску, а й дозволяють регулювати їх за потреби. Реакції каталізовані ферментами часто об'єднуються у послідовності, де продукт однієї стає субстратом для наступної, такі серії реакцій називаються метаболічними шляхами. Метаболічні шляхи, своєю чергою, поєднуються між собою, утворюючи складні розгалужені сітки.
Важливою властивістю основних метаболічних шляхів та їх складових є те, що вони спільні для більшості живих організмів, а це свідчить про єдність походження живої природи. Проте певні особливості метаболізму має не лише кожен вид, а й окремі особини в межах виду.
Термодинаміка живих систем ред.
Другий закон термодинаміки говорить, що ентропія (міра невпорядкованості) в ізольованій системі постійно зростає. Іншими словами можна сказати, що безлад «наводиться сам», а для впорядкування системи потрібно виконати хімічну, механічну та транспортну роботу. Її постійно змушені виконувати організми, для того, щоб підтримувати життєдіяльність, це відбувається завдяки наявності метаболізму.
Частину енергії системи, що може виконувати роботу за незмінних тиску та температури називають вільною енергією Гіббса (G). Під час хімічної реакції зміну вільної енергії можна описати так:
- ,
де ΔН — зміна ентальпії, що відображає кількість утворених та зруйнованих зв'язків (негативна для реакцій, в яких виділяється тепло), T — абсолютна температура, ΔS — зміна ентропії. За стандартних умов і концентрації реагентів та продуктів реакції 1 моль/л зміна вільної енергії називається стандартною ΔG0.
Системи із великим запасом вільної енергії є нестабільними, в них самовільно відбуваються процеси, що зменшують її. Отже, спонтанно можуть відбуватись тільки реакції, що супроводжуються виділенням енергії (ΔG < 0), вони називаються екзергонічними, але не реакції, для яких ΔG > 0 (ендергонічні). У стані термодинамічної рівноваги ΔG=0 і система не може виконувати роботу. Досягнення стану рівноваги для клітини означає смерть.
Якщо пряма реакція екзергонічна, як, наприклад, окиснення глюкози до вуглекислого газу та води (ΔG0 = −686 ккал/моль (2879 кДж/моль)), то зворотна обов'язково буде ендергонічною, тобто для реакції синтезу глюкози із вуглекислого газу та води ΔG0 = +686 ккал/моль.
Зміна вільної енергії під час реакції залежить від її конкретного типу (тобто вмісту енергії у вихідних речовинах і продуктах), а також від того, наскільки далеко була система від термодинамічної рівноваги у початковий момент часу (тобто наскільки концентрації речовин відрізняються від рівноважних). Наприклад для реакції:
(маленькими буквами позначені стехіометричні коефіцієнти) зміну вільної енергії можна виразити як функцію стандартної зміни вільної енергії ΔG0:
- (1), де [Ai], [Bi], [Ci], [Di] — концентрації речовин в момент початку реакції.
Здатність реакції проходити до кінця характеризує константа рівноваги, для наведеної вище реакції вона записуватиметься так:
- ,
де [Aeq], [Beq], [Ceq], [Deq] — концентрації речовин у стані рівноваги. Чим більша константа рівноваги, тим більше вихідних речовин перетворюються у продукти до наступання стану рівноваги.
За умов рівноваги ΔG=0, і формула (1) видозмінюється таким чином:
В реальних умовах живої клітини більшість хімічних реакцій ніколи не досягають рівноважного стану через те, що продукти постійно використовуються в інших реакціях або виділяються у середовище. Таким чином жива система перебуває у динамічно стабільному стані: у ній відбуваються неперервні зміни внаслідок току речовини та енергії, але основні показники підтримуються на сталому рівні. Наприклад глюкоза з одного боку поглинається з крові і використовується багатьма тканинами, з іншого — всмоктується із кишківника та мобілізується з місць її запасання. Внаслідок поєднання цих двох процесів її концентрація у крові залишається досить стабільною.
Активовані переносники ред.
У клітині постійно відбувається велика кількість ендергонічних реакцій, це стає можливим тільки завдяки їх спряженню із екзергонічними. Таким чином значення зміни вільної енергії обох процесів додаються і сумарне ΔG < 0.
У більшості реакцій джерелом вільної енергії є розщеплення фосфодіестерних зв'язків аденозинтрифосфату. Як приклад можна розглянути фосфорилювання глюкози (перша реакція гліколізу):
- 1) глюкоза + Фн → глюкозо-6-фосфат + вода, ΔG0
1 > 0;
Для реакції гідролізу АТФ:
- 2) АТФ + вода → АДФ + Фн, ΔG0
2 < 0.
Оскільки |ΔG1| < |ΔG2|, то сумарна зміна вільної енергії спряженої реакції буде від'ємною.
Гідроліз АТФ дає багато енергії з двох причин. По-перше, це пов'язано із особливістю самої молекули: три фосфатні групи в молекулі АТФ мають негативний заряд і відштовхуються між собою, в такому стані її можна порівняти із стиснутою пружиною. Відщеплення одного фосфату — енергетично вигідний процес, як вистрілювання пружини. Тому стандартна зміна вільної енергії для гідролізу АТФ до АДФ має негативне значення −7,3 ккал/моль. Другою причиною є те, що співвідношення концентрацій АТФ/АДФ у клітині значно більше за рівноважне, тому в реальних умовах розщеплення одного моль АТФ дає приблизно 13 ккал енергії. Проте для проходження деяких реакцій, наприклад полімеризації нуклеотидів у нуклеїнову кислоту, цієї енергії недостатньо, тому відбувається відщеплення пірофосфату із утворенням АМФ, при цьому ΔG = −26 ккал/моль.
Зворотний процес до гідролізу АТФ — фосфорилювання АДФ є ендергонічним процесом, що у свою чергу спряжений із екзергонічними реакціями, такими як окиснення органічних речовин. Таким чином АТФ є переносником енергії від одних метаболічних реакцій до інших. Швидкість обігу АТФ в організмі дуже велика, кожна клітина щохвилини гідролізує і знову синтезує близько 10 мільйонів молекул цієї речовини. М'язові волокна під час роботи використовують весь свій запас АТФ менш ніж за хвилину. Якщо регенерація АТФ із АДФ була б неможливою, людині для життєдіяльності щодня була б потрібна маса цієї речовини майже рівна масі її тіла.
В метаболічних реакціях беруть участь також інші активовані переносники, наприклад нікотинові коферменти НАД+ та НАДФ+. Вони переносять електрони та протони, за цією здатністю коферменти не відрізняються між собою, проте вони мають дещо різні функції. НАД переважно використовується для реакцій окиснення, тому в клітині підтримується високе співвідношення окисненої і відновленої форми (НАД+/НАДН(H+)). Натомість НАДФ у більшості випадків діє як відновник завдяки низькому співвідношенню НАДФ+/НАДФН(H+. До інших активованих посередників належать ацетил-кофермент А, ФАДH2, каброксильнований біотин, S-аденозилметіонін, УДФ-глюкоза тощо. Більшість активованих переносників є похідними вітамінів.
Каталіз метаболічних реакцій ред.
Із термодинамічних показників, таких як зміна вільної енергії, можна зробити висновок тільки про можливість проходження певної реакції, але вони нічого не говорять про швидкість, з якою вона протікатиме. Наприклад сахароза менш термодинамічно стабільна, ніж суміш глюкози та фруктози, проте спонтанний гідроліз (ΔG0 = −7 ккал/моль) відбувається надзвичайно повільно. Стерильний розчин сахарози може зберігатись тривалий час у майже незмінному стані, через те, що він є кінетично стабільним.
Для нормальної життєдіяльності в клітині щосекунди повинна відбуватись безліч хімічних реакцій, проходження яких за нормальних умов може займати роки. Для їх пришвидшення використовуються ферменти — каталізатори білкової природи. Ферменти ніяк не випливають ΔG, вони не можуть зробити енерогонічні процеси екзергонічними, також вони не зміщують рівноваги реакції, а тільки прискорюють момент її наступання, при чому самі не змінюються у процесі.
Основний механізм дії ферментів полягає у зменшенні енергії активації. Перетворення вихідних речовин у продукти реакції майже завжди передбачає наявність високоенергетичного перехідного стану, який створює бар'єр для перебігу реакції. Ферменти побудовані таким чином, що зв'язування їхнього активного центру із речовиною у перехідному стані є енергетично вигідним, що й дозволяє зменшити активаційний бар'єр. Крім того, білкові каталізатори орієнтують субстрати таким чином, що вони можуть легко реагувати між собою. Завдяки цим властивостям ферменти прискорюють хімічні перетворення у трильйони раз (1012—1014).
Ферменти високоспецифічні, зазвичай один фермент каталізує одну реакцію, і кожна реакція каталізуються одним ферментом, хоча є багато винятків. Активність багатьох ферментів може регулюватись. Крім білків роль каталізаторів у клітині можуть виконувати молекули РНК (рибозими), іони металів тощо.
Метаболічні шляхи ред.
|
Одинарні лінії: шляхи, звичні для усіх форм життя. Подвійні лінії: шляхи, що відсутні в людини (проходять наприклад у рослин, грибів, прокаріотів). Помаранчеві вузли: обмін вуглеводів[en]. Фіолетові вузли: Фотосинтез. Червоні вузли: Клітинне дихання. Рожеві вузли: Сигнальні системи клітин. Голубі вузли: Метаболізм амінокислот[en]. Сірі вузли: метаболізм вітамінів та кофакторів. Коричневі вузли: нуклеотидів[en] та білків[en]. Зелені вузли: метаболізм ліпідів[en]. Сірі прямокутники та написи — органели. |
Серії реакцій в клітині переважно об'єднуються у метаболічні шляхи, в яких продукт одного перетворення стає субстратом для наступного. Зазвичай ферменти одного метаболічного шляху групуються разом, утворюючи великі мультиензимні комплекси.
Деякі шляхи забезпечують розщеплення складних органічних речовин і запасання енергії у формі хімічних зв'язків АТФ, в результаті чого його концентрація в клітині підтримується на досить високому рівні. Також в цих реакціях відновлюються НАД і НАДФ. Сукупність таких метаболічних шляхів називається катаболізмом (дисиміляція, енергетичний обмін).
Інші шляхи полягають у синтезі складних молекул із простіших попередників (наприклад полімерів із мономерів), вони завжди потребують енергії і описуються загальним терміном анаболізм (асиміляція, пластичний обмін). Зв'язними ланками між катаболізмом та анаболізмом є АТФ та інші нуклеотидтрифосфати. Інколи виділяють ще так звані амфіоблічні шляхи — перехрестя катаболізму та анаболізму.
Хоча уявлення про метаболізм як сукупність окремих шляхів зручне для його вивчення і систематизації, воно надто спрощене, щоби відповідати дійсності. Багато із проміжних продуктів є частиною кількох шляхів. Через це метаболізм найкраще описується як складна сітка взаємопов'язаних реакцій, в якій зміна концентрації навіть однієї речовини викликає суттєві наслідки у багатьох її частинах.
Регуляція метаболічних шляхів ред.
Для того, щоб величезна кількість метаболічних реакцій працювали злагоджено, на користь клітині, вони повинні бути регульованими. Така регуляція забезпечується основними шляхами: активацією або пригніченням синтезу певних ферментів, та зміною їхньої активності. Перший метод повільніший і дає стійкіші результати, другий дозволяє миттєву відповідь.
Багато ключових ферментів метаболічних шляхів є алостеричними, тобто такими, що крім активного центру мають додатковий сайт для зв'язування регуляторних молекул, що змінюючи конформацію білка впливають на його активність. Алостеричні модулятори можуть бути як активуючими, так і інгібуючими.
Окрім того, регуляція метаболічних шляхів може відбуватись шляхом зміни доступності субстратів. Наприклад, багато клітин можуть розщеплювати глюкозу тільки в тоді, коли на них діє інсулін, що стимулює транспорт цієї речовини із крові. В еукаріотичних клітинах протилежно напрямлені метаболічні шляхи часто розподілені по різних компартментах. Наприклад, окиснення жирних кислот відбувається у мітохондріях, а синтез — у цитоплазмі. Перехід субстратів з одного компартменту в інший може слугувати точкою контролю.
Оскільки одним із першочергових завдань метаболізму є підтримання гомеостазу (динамічної сталості внутрішніх умов), більшість його регуляторних шляхів організовані за принципом негативного зворотного зв'язку: метаболічний шлях пригнічується його кінцевим продуктом, що діє на один із перших ферментів цього шляху. Наприклад амінокислота ізолейцин синтезується із треоніну у п'ять кроків. Коли в клітині виробляється більше ізолейцину ніж потрібно для синтезу білків, його надлишок пригнічує перший фермент цього метаболічного шляху і синтез припиняється до того часу, поки концентрація амінокислоти не зменшиться.
Типи живлення ред.
Майже всі перетворення енергії у метаболічних реакціях можна звести до перенесення електронів між речовинами, тобто до окисно-відновних реакцій. Різні сполуки відрізняються за спорідненістю до електронів. Електрони під впливом електрорушійної сили рухаються від речовин із меншою спорідненістю до речовин із більшою спорідненістю, в цьому процесі їхня енергія вивільняється, її частина може бути використана для корисної роботи.
| Джерело енергії | світло | фото- | -трофи |
| готові хімічні сполуки | хемо- | ||
| Донор електронів | органічні сполуки | органо- | |
| неорганічні сполуки | літо- | ||
| Джерело карбону | органічні сполуки | гетеро- | |
| неорганічні сполуки | авто- |
Організми, для яких джерелом високоенергетичних електронів є відновлені речовини середовища, називаються хемотрофами (тобто вони живляться хімічною енергією). Вони поділяються на хемоорганотрофів, що окиснюють органічні сполуки, та літотрофів, джерелом енергії для яких є неорганічні сполуки. Інша група організмів — фототрофи, також може використовувати як джерело електронів органічні або неорганічні речовини, проте енергію ці електрони здобувають під впливом світла, що переводить їх у збуджений стан.
Крім джерела енергії та електронів організми також потребують хімічних елементів, у найбільшій кількості Карбону, Гідрогену та Оксигену. Ті види, які можуть засвоювати ці елементи у формі неорганічних речовин, таких як вуглекислий газ і вода, та синтезувати із них органічні, називаються автотрофами. Ті ж, які не здатні до цього, належать до гетеротрофів.
Дві найпоширеніші групи живих організмів це фотолітоавтотрофи, наприклад зелені рослини, водорості та ціанобактерії використовують енергію світла, воду як джерело електронів та вуглекислий газ для синтезу органічних речовин, і хемоорганогетеротрофи, такі як тварини, гриби і частина прокаріот, що отримують енергію, електрони і вуглець з органічних сполук. Рідше зустрічаються фотоорганогетеротрофи (пурпурові та зелені несірчані бактерії), хемолітоавтотрофи (залізобактерії, нітрифікуючі бактерії тощо) та міксотрофи, що можуть перемикатись із одного типу живлення на інший.
Дисиметрія ред.
Дисиметрія основних речовин спричинює певну дисиметрію в основних продуктах живлення, визначаючи їх налаштування. Наприклад, дріжджі вживають лише природні D-цукри, залишаючи "неприродні" (у середовищі з них одних вони не ростуть). Суттєво відрізняються й "транспортні властивості" антиподів - біологічні мембрани пропускають один з них й затримують інший.
Речовини, які відіграють в організмі вторинну роль - несуть функції обмінних, метаболіти, харчові запаси, екскрети - вже менше підпорядковуються правилу дотримання знаку і можуть, залежно від умов, існувати в обох конфігураціях або у вигляді їх суміші - "рацемату". Речовини "небіологічного" знаку часто зустрічаються в антибіотиках, зокрема D-амінокислоти й цукри "неприродних" знаків деструктивно впливають на бактерії; вони отримуються іншими шляхами синтезу, а ніж природні.
У живих системах як первинні переважають хіральні молекули. Життєво важливі речовини, особливо які відносяться до основної конституціональної частини, існують в організмах у вигляді оптично чистих ізомерних форм, тобто у вигляді одного з антиподів. У більш важливих речовин переважає один, відповідний для кожної речовини, знак конфігурації в усій біосфері.
Дисиметрія спостерігається й у конформаціях біополімерів - "конструкцій", складених з хіральних молекул, тобто в наступних ланках ієрархії біологічних структур:
Дисиметрія простежується у всіх живих системах від бактерій до вищих організмів та людини у найрізноманітніших життєвих функціях й відправленнях, аж до психіки. А.Р. Кізель показав, що система основного обміну у всіх особин мають однаковий знак: індивідууми правої та лівої морфологічної структури споживають харчі одного знаку тощо[1].
Катаболізм ред.
Реакції катаболізму — це окиснення органічних речовин, тобто відщеплення від них електронів. Кінцевим акцептором цих електронів можуть виступати ендогенні органічні речовини, наприклад піровиноградна кислота, такий тип катаболізму називається бродінням переважно протікає за відсутності кисню і є основним шляхом отримання енергії для багатьох мікроорганізмів. Якщо у серії катаболічних реакцій кінцевим акцептором електронів є екзогенні речовини, то вона називається клітинним диханням. Дихання поділяється на аеробне, при якому акцептором виступає кисень, та анаеробне, акцепторами є інші речовини, переважно неорганічні, такі як NO-
3, SO2-
4, CO2, Fe3+, SeO-
4 тощо, але інколи й органічні, наприклад фумарат. Усі типи клітинного дихання включають ланцюги транспорту електронів.
Аеробне дихання хемоорганогетеротрофних організмів можна поділити на три стадії:
- Підготовчий етап — перетравлення, розщеплення біополімерів до їх мономерів. Цей етап відбувається у травній системі, або внутрішньоклітинно у лізосомах. У хімічних реакціях не виділяється достатньої кількості енергії для синтезу АТФ, вся вона втрачається у формі тепла. Продуктами підготовчого етапу є амінокислоти, моносахариди, жирні кислоти, гліцерол та інші речовини.
- Безкисневий (анаеробний етап) — розщеплення мономерів до ще менших молекул, переважно ацетил-КоА, на цьому етапі у реакціях субстратного фосфорилювання синтезується певна кількість АТФ та відновлюється НАД або/і ФАД. Одним із основних метаболічних шляхів другого етапу аеробного дихання є гліколіз, у якому перетворюється глюкоза та інші сполуки.
- Кисневий (аеробний етап) включає цикл Кребса та електронтраспортний ланцюг, відбувається у мітохондріях. На цьому етапі органічні речовини окиснюються до вуглекислого газу, а всі відщеплені від них електрони та протони переносяться на кисень, внаслідок чого утворюється вода. На цьому етапі відбувається як субстратне, так і окисне фосфорилювання і синтезується найбільша кількість АТФ.
| Етапи (види) | Значення |
|---|---|
| Підготовчий етап | Підготовчий етап — розщеплення високомолекулярних органічних речовин до мономерів на основі реакцій гідролізу у травному каналі або у лізосомах клітин за участі равних ферментів:
Енергія, яка утворилася на цьому етапі, розсіюється у вигляді тепла |
| Безкисневий етап (гліколіз) | Гліколіз відбувається за участі ферментів, що розміщені у розчинній частині цитоплазми. 60 % енергії втрачається у вигляді тепла, а 40 % йде на синтез двох молекул АТФ. Крім АТФ у процесі гліколізу утворюються дві молекул пірвиноградної кислоти (пірувату) та відновлюються дві молекули коферменту НАД до НАДН(Н+):
Складові реакції гліколізу
|
| Аеробне окиснення, цикл Кребса (аеробні організми) | Аеробне (кисневе) окиснення здійснюється в мітохондріях, куди потрапляє піровинградна кислота. В матриксі мітохондрій відбувається окисне декарбоксилювання пірувату, що має наслідком утворення однієї молекули ацетил-коферменту А, виділення однієї молекули вуглекислого газу та відновлення однієї молекули НАД. Ацитил-КоА поступає у цикл Кребса, за один оборот цього циклу окиснюється одна молекула ацетил-КоА, відновлюються три молекули НАД та одна молекула ФАД, і як побічний продукт виділяються дві молекули вуглекислого газу.
Складові реакції циклу Кребса
Відновні еквіваленти НАДН та ФАДН2 переносять електрони та протони до електронтранспортного ланцюга внутрішньої мембрани мітохондрій, де відбувається окисне фосфорилювання із утворенням 3ох молекул АТФ, при перенесенні електронів від НАДН і 2ох молекул АТФ при перенесенні електронів від ФАДН2 . Кінцевим акцептором електронів є кисень:
|
| Бродіння (анаеробні організми) | Бродіння — безкисневе перетворення пірувату на інші речовини.
У аеробних організмів за інтенсивної роботи м'язів відбувається молочнокисле бродіння. Це забезпечує певну незалежність м'язів від об'єму кисню, який може окиснювати піруват за певний проміжок часу |
Анаболізм ред.
Біосинтез білків ред.
| Стадія | Етапи | Значення | |
|---|---|---|---|
| Транскрипція | Ініціація | Ініціація потребує наявності субстратів РНК-полімерази — нуклеотидів — та зумовлює утворення перших ланок ланцюга РНК. Перший нуклеотид входить до складу ланцюга, зберігаючи трифосфатну групу, а інші приєднуються до 3’-OH-групи наступного з вивільненням пірофосфату. На стадії ініціації РНК-продукт пов'язаний з матрицею та РНК-полімеразою нещільно, та з високою ймовірністю вивільнюється з комплексу. РНК-полімераза, не залишаючи продукт, знову ініціює РНК (абортивна ініціація). При досягненні довжини ланцюга РНК від 3 до 9 нуклеотидів комплекс стабілізується (також відбувається від'єднання σ-субодиниці, яка зв'язує РНК-полімеразу з промотором). Залежить від факторів транскрипції | |
| Елонгація | Синтез всіх видів РНК на відповідній ділянці (матриці) ДНК за допомогою ферменту ДНК-залежної РНК-полімерази, яка будує, за принципом комплементарності, копію одного ланцюга ДНК. ДНК-зв'язувальні білки розплітають молекулу ДНК перед РНК-полімеразою, гістони заплітають позаду неї | ||
| Термінація | Досягнення РНК-полімеразою стоп-кодону, розрізання РНК, додавання до 3’-кінця транскрипту декілька нуклеотидів аденіну для стабільності транскрипту | ||
| Процесинг | Дозрівання пре-мРНК еукаріот до зрілих мРНК, відбувається безпосередньо під час транскрипції в складі РНК-полімеразного комплексу[2]: кепування (приєднання до 5’ кінця транскрипту модифікованого нуклеотиду за допомогою трифосфатного моста), сплайсинг (відщеплення інтронів за допомогою ферменту сплайсосоми), поліаденілування (приєднання 200—300 залишків аденілової кислоти), редагування мРНК (зміна нуклеотидів в структурі мРНК). | ||
| Трансляція | Активація амінокислоти | Амінокислота з'єднується з антикодоном тРНК за рахунок енергії АТФ; утворюється комплекс аміноацил-тРНК, що зумовлюється ферментом аміноацил-РНК-синтетазою, що каталізує приєднання амінокислоти до тРНК) та їх перенесення на рибосому; | |
| Ініціація | Початок синтезу білка з кодону АУГ, що зумовлюється притягненням малою субодиницею рибосоми комплексу амінокислота-тРНК до цієї послідовності. Кодування першої амінокислоти — метіоніну. Зумовлюється зв'язуванням мРНК (упізнається рибосомою через кепіруваний 5’ кінець.) та тРНК з малою субодиницею внаслідок зміни конформації одного з факторів ініціації (IF2) ГТФ. Після виходу із взаємодії IF1 та IF3 (пригнічує асоціацію з великою субодиницею рибосоми до її зв'язку з мРНК) утворюється зв'язування із комплексом 50S-субодиниці, що зумовлює повну конформацію усього комплексу. Утворюється ФЦР (функціональний центр рибосоми). У ФЦР є два триплети мРНК, що утворюють два центри: А (впізнавання амінокислоти) та П (приєднання амінокислоти до пептидного ланцюга). Метіонін-комплекс переміщується у П-центр рибосоми | ||
| Елонгація | Синтез білка (транспорт комплексу амінокислота-тРНК до ФЦР. У центрі А — зчитування антикодону тРНК і кодону мРНК, що зумовлює пересування рибосоми на один триплет. У результаті комплекс амінокислота-іРНК-тРНК переміщується у центр П, де відбувається приєднання амінокислоти до пептидного ланцюга. Після цього тРНК залишає рибосому); | ||
| Термінація | Закінчення синтезу (початок беззмістовних кодонів на мРНК. Роз'єднання амінокислот з мРНК та розпад рибосом на дві субодиниці. Поліпептидний ланцюг занурюється у канал ЕПС і набуває різних типів структур (вторинної тощо)) | ||
Фотосинтез ред.
| Етап | Суть |
|---|---|
| Світлова фаза | Світлова фаза — комплекс реакцій, що відбувається під дією фотонів світла на мембранах тилакоїдів
При потраплянні квантів світла на хлорофіл молекули хлорофілу збуджуються. Збуджені електрони проходять по електронному ланцюгові на мембрані до синтезу АТФ. Одночасно відбувається розщеплення молекул води. Йони H+ сполучаються з відновленим НАДФ (ФС1) за рахунок електронів хлорофілу; виділена при цьому енергія йде на синтез АТФ. Йони O2- віддають електрони на хлорофіл (ФС2) і перетворюються на вільний кисень: H2O + НАДФ + hν → НАДФН + H+ + 1/2O2 + 2АТФ |
| Темнова фаза | Темнова фаза — фіксація C, синтез C6H12O6. Джерелом енергії є АТФ. У стромі хромопластів (куди надходять АТФ, НАДФН та H+ від тилакоїдів гран та CO2 з повітря) проходять циклічні реакції, у результаті чого є фіксація CO2, його відновлення H (за рахунок НАДФН + H+) та синтез C6H12O6:
CO2 + НАДФН + H+ + 2АТФ → 2АДФ + C6H12O6 |
Біосинтез вуглеводів (глюконеогенез та глікогенез) ред.
| Етап | Суть |
|---|---|
| Мітохондріальний етап | У мітохондріях фермент піруваткарбоксилаза перетворює ПВК у оксалоацетат. При цьому для виходу із мітохондрії оксалоацетат перетворюється у малат за допомогою ферменту малатдегідрогінази, який легко дифундує через мембрану мітохондрії. Поза мітохондрії малат знову дисоціює у оксалоацетат (щавелеоцтова кислота). У цитоплазмі він за допомогою фосфоенолпіруваткарбоксикінази перетворюється у фосфоенолпіруват. Для перетворення лактату у фосфоенолпіруват потрібен також фермент лактатдегідрогеназа
Складові реакції мітохондріального етапу
|
| Позамітохондріальний етап | Під дією ферментів фосфоенолпіруват поступово перетворюється у глюкозу. 10 % глюконеогенезу відбувається у нирках, 90 % — у печінці. За день може синтезуватися до 80 г глюкози
Складові реакції позамітохондріального етапу
|
| Етап | Суть |
|---|---|
| Приєднання глюкози до ланцюга глікогену | Загалом процес утворення глікогену, що стимулюється гормоном інсуліном, який посилює приток глюкози до клітин
Складові реакції глікогенезу
|
Біосинтез ліпідів (ліпогенез) ред.
| Етап | Суть |
|---|---|
| Дигідроацетон-3-фосфат — фосфатиди | Відбувається у цитоплазмі. При відновленні проміжного продукту гліколізу, дигідроксиацетон-3-фосфату, або при фосфорелюванні гліцерину утворюється sn-3-гліцерофосфат. При його етерифікації по С-1 довголанцюговою жирною кислотою утворюються лізофосфатиди, при повторній етерифікації (утворенні складних ефірів з жирних кислот) ненасиченої жирної кислоти по С-2 — фосфатиди, ключові проміжні продукти в біосинтезі ліпідів; |
| Фосфатидати — триацилгліцерини | З фосфатидових кислот після гідролітичного розщеплення фосфатної групи та наступного ацилірування (введення залишку кислоти -RCO) утворюються триацилгліцерини (жири), які зберігаються у цитоплазмі у вигляді крапель |
Еволюція метаболізму ред.
Всі відомі живі організми містять такі активовані переносники, як АТФ, НАД, ФАД та кофермент А. Ці сполуки об'єднує те, що до їх складу входить аденозин дифосфат, причому він не бере безпосередньої участі у перенесенні електронів та хімічних груп. Найпереконливішим поясненням цієї закономірності є те, що перші живі системи використовували як каталізатори молекули РНК, які, проте, не могли виконувати функції переносників енергії. Імовірно, що вже у ранньому РНК світі такі речовини як НАД, ФАД, кофермент А стали частиною метаболізму, а аденозин дифосфатні групи їм були необхідні для того, щоб взаємодіяти із рибозимами через утворення водневих зв'язків із залишками урацилу в їхньому складі.
Із розвитком білкових каталізаторів активовані переносники мало змінились, оскільки вони вже були добре налаштовані на виконання своїх функцій. Їх нуклеотидна частина тепер використовується для взаємодії із певними амінокислотними послідовностями у складі ферментів. Наприклад НАДН може однаково успішно передавати електрони, незалежно від того, чи його аденіновий залишок приєднується до ділянки білка чи РНК.
Аналоговий метаболізм ред.
(у біохімії) Біологічний розклад стійкої за даних умов до біодеградації сполуки у присутності іншої структурноподібної сполуки, яка індукує необхідні для цього ензими.
Див. також ред.
Примітки ред.
- ↑ В.А.Кизель - Физические причины диссимметрии живых систем.
- ↑ А. В. Сиволоб (2008). Молекулярна біологія (PDF). К: Видавничо-поліграфічний центр "Київський університет". Архів оригіналу (PDF) за 4 березня 2016. Процитовано 21 червня 2014.
Посилання ред.
- Метаболізм // Словник-довідник з екології : навч.-метод. посіб. / уклад. О. Г. Лановенко, О. О. Остапішина. — Херсон : ПП Вишемирський В. С., 2013. — С. 121.
- МЕТАБОЛІЗМ [Архівовано 16 квітня 2016 у Wayback Machine.] //Фармацевтична енциклопедія
- Метаболізм // Українська мала енциклопедія : 16 кн. : у 8 т. / проф. Є. Онацький. — Буенос-Айрес, 1961. — Т. 4, кн. VIII : Літери Ме — На. — С. 965. — 1000 екз.
Джерела ред.
- Атлас метаболічних шляхів : навчальний посібник / Зоя Михайлівна Скоробогатова ; НАН України, Ін-т фіз.-орган. хімії і вуглехімії ім. Л. М. Литвиненка. – Київ : Академперіодика, 2017. – 73, [2] с.
- Campbell NA, Reece JB (2008). Biology (вид. 8th). Benjamin Cammings. с. 142—159. ISBN 978-0321543257. Архів оригіналу за 3 березня 2011. Процитовано 25 квітня 2012.
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2007). Molecular Biology of the Cell (вид. 5th). Garland Science. с. 65—84. ISBN 978-0-8153-4105-5. Архів оригіналу за 22 липня 2011. Процитовано 25 квітня 2012.
- Nelson D.L., Cox M.M. (2008). Lehninger Principles of Biochemistry (вид. 5th). W. H. Freeman. с. 19—26. ISBN 978-0-7167-7108-1.
- Berg JM, Tymoczko JL, Stryer L (2007). Biochemistry (вид. 6th). W.H. Freeman and Company. ISBN 0-7167-8724-5.
- Prescott L.M. (2002). Microbiology (вид. 5th). McGraw−Hill. ISBN 0-07-282905-2.
| Це незавершена стаття з біохімії. Ви можете допомогти проєкту, виправивши або дописавши її. |