Пероксисома
Пероксисо́ма — клітинна органела (раніше відома як мікротільце), оточена єдиною мембраною, не містить ДНК і рибосом (на відміну від мітохондрій і хлоропластів). Пероксисоми наявні в цитоплазмі практично усіх еукаріотичних клітин. Вони містять окиснювальні ферменти, які часто використовують молекулярний кисень як ко-субстрат з відповідним утворенням пероксиду водню (H2O2). Пероксисоми відіграють значну роль у метаболізмі ліпідів, утворенні та інактивації активних форм кисню. Основними функціями пероксисом є катаболізм дуже довголанцюгових жирних кислот[en], жирних кислот з розгалуженим ланцюгом[en], проміжних продуктів метаболізму жовчних кислот, D-аміно кислот, поліамінів, відновленні активних форм кисню (особливо пероксиду водню[1]), біосинтезі плазмалогенів[en] (наприклад, етеро-фосфоліпідів[en], які є критично важливими для функціонування мозку і легенів у ссавців[2]). Також в пероксисомах знаходиться близько 10% активності двох ферментів пентозо-фосфатного шляху – глюкозо-6-фосфат-дегідрогенази та 6-фосфоглюконат дегідрогенази[en][3][4]. І досі ведуться дискусії стосовно ролі пероксисом в синтезі ізопреноїдів[4]. Ще однією важливою функцією пероксисом є забезпечення гліоксилатного циклу[ru] в проростках рослин (в рослин пероксисоми відповідальні за цю функцію називаються "гліоксисоми") та фотодихання в листках. В метилотрофних дріжджів гліоксисоми відповідальні за окиснення метанолу і в деяких дріжджів також/або окиснення амінів. В трипаносом гліколіз протікає в пероксисомах, які названо "глікосомам".
Історія вивчення
ред.Як окрему структуру пероксисому вперше описав 1954 року Родін у клітинах нирки миші.[5] Ці структури були оточені однією мембраною та містили добре виражений гранулярний матрикс. Через малий розмір і невизначений вигляд дослідник назвав їх «мікротільцями». 1960 року та пізніше Крістіан де Дюв із колегами показав, що пероксисоми містять такі ферменти, як уратоксидаза[en], каталаза, оксидаза-D-амінокислот[en]. Виявилось, що в пероксисомах молекулярний кисень під впливом оксидази перетворюється в пероксид водню, який каталаза розкладає на воду та кисень. Це відкриття дозволило де Дюву назвати цю органелу «пероксисомою». Водночас інша група дослідників, очолювана Біверсом, показала, що гліоксилатний цикл[ru] у зернах, що проростають, перебігає в невідомих доти цитоплазматичних часточках, які вони назвали «гліоксисомами». Гліоксисоми за своїми властивостями дуже нагадували пероксисоми. Було встановлено, що в гліоксисомах також перебігає β-окиснення жирних кислот. Пізніше було відкрито, що цей процес відбувається і в пероксисомах печінки пацюка. Зараз гліоксисоми вважають видозміненими пероксисомами. Також було показано, що в люцефераза світлячків за гетерогенної експресії в клітинах ссавців локалізується в пероксисомах, що призвело до відкриття сигнального пептиду, який відповідальний за транспорт білків в матрикс пероксисом. Це відкриття суттєво пришвидшило подальше дослідження пероксисом і їхнього біогенезу[6][7]
Морфологія та розташування
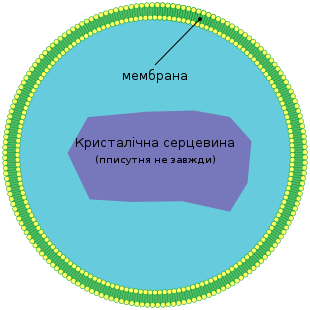
ред.Пероксисоми є невеликими мембранними органелами з діаметром близько 0.1-1 µм, оточені однією біомембраною та містять всередині гранулярний матрикс [8][9]. Компменталізація пероксисом створює оптимальні умови для протікання різних метаболічних реакцій необхідних для підтримання клітинних функцій і життєздатності всього організму.
Пероксисоми наявні у всіх ядерних клітинах. Розмір, кількість і білковий склад пероксисом суттєво відрізняється в клітинах різних тканин, а також може змінюватись під впливом зовнішніх стимулів. Наприклад, у дріжджів які вирощують на цукрі, пероксисоми маленькі. Однак у дріжджів, вирощених на метанолі, наявні великі пероксисоми, які окиснюють метанол. Якщо дріжджі (наприклад, S. cerevisiae),вирощують за присутності лише жирних кислотах, то вони утворюють приблизно 20-25 великих пероксисом[10], в яких інтенсивно перебігає β-окиснення жирних кислот. У вищих хребетних тварин особливо багаті пероксисомами клітини печінки та нирок. Так, кожен гепатоцит пацюка містить від 70 до 100 пероксисом.
Функції
ред.Однією з основних функцій пероксисом є розщеплення довголанцюгових жирних кислот завдяки бета-окисненню. В клітинах ссавців довголанцюгові жирні кислоти розщеплюються до жирних кислот з середньою довжиною ланцюга, які в подальшому транспортуються до мітохондрії де відбувається їхнє остаточне розщеплення з утворенням діоксиду вуглецю і води. В дріжджах і рослин бета-окиснення жирних кислот відбувається виключно в пероксисомах [11][12].
Перша реакція біосинтезу плазмалогену в клітинах тварин також відбувається в пероксисомах. Плазмалоген це основний фосфоліпід мієліну. Дефекти в синтезі плазмалогену призводять до проблем з утворенням мієлінової оболонки нерва і є причиною частих порушень діяльності нервової системи в пацієнтів з генетичними порушеннями діяльності пероксисом[en][11]. Пероксисоми також відіграють роль у синтезу жовчних кислот, які необхідні для всмоктування жирів і жиро-розчинних вітамінів (вітамін А, вітамін К). Тому, частою ознакою генетичних порушень діяльності пероксисом є проблеми зі шкірою.[12]
Метаболічними шляхами, які знаходяться виключно в пероксисомах ссавців є:[4]
- α-окислення фітанової кислоти[en]
- β-окислення дуже довголанцюгових і поліненасичених жирних кислот
- біосинтез плазмалогенів
- кон'югація холінової кислоти як частина синтезу жовчних кислот
В пероксисомах знаходяться оксидативні ферменти, такі як оксидаза D-амінокислот і уратооксидаза[13]. Однак, останній фермент відсутній у людини. Відсутність цього ферменту лежить в основі патогенезу подагри. У пероксисомі зазвичай наявні ферменти, що використовують молекулярний кисень для відщеплення атомів водню від деяких органічних субстратів ( ) із утворенням пероксиду водню ( ):
- .
Каталаза (ще один типовий пероксисомальний фермент) використовує утворений H2O2 для окиснення багатьох субстратів, таких як феноли, мурашиної кислоти, етанолу та формальдегіду:
- .
За допомогою цієї реакції в печінці відбувається знешкодження різних отруйних речовин, що містяться в крові. Близько 25 % спожитого етанолу пероксисоми окиснюють до ацетальдегіду.[11]
Коли в клітині накопичується надмірна кількість пероксиду водню, каталазу перетворює його у воду завдяки такій реакції:
- .
У вищих рослин в пероксисомах також знаходиться ряд антиоксидантних ферментів, таких як супероксиддисмутаза, компоненти аскорбат-глутатіонового циклу і НАДФ-залежні дегідрогенази пентозфосфатного циклу. Також було показано, що в пероксисомах відбувається синтез радикалів супероксиду (O2•−) і оксиду нітрогену (•NO)[14][15]. Є факти, що вказують на роль вищезгаданих окисних молекул в сигнальних шляхах клітин ссавців і рослин і їхній вплив на старіння.[16]
Під час грибкового зараження клітини рослин виділяють глюкозинолат[en] завдяки пероксисомальним білкам PEN2 і PEN3 [17].
Пероксисоми у ссавців також відіграють роль у антивірусному захисті[18] і захисті від патогенів [19].
Інші функції
ред.У тварин у пероксисомах перебігають перші реакції біосинтезу плазмалогенів — найпоширеніших фосфоліпідів мієліну. Активно обговорюється роль пероксисом у біосинтезі ізопроноїдів і холестеролу у тварин.
На пероксисоми припадає близько 10 % активності двох ферментів пентозофосфатного шляху: глюкозо-6-фосфатдегідрогенази та 6-фосфоглюконатдегідрогенази, які, як передбачається, за мірою потреби поповнюють пул НАДФ-H поза пероксисомою.
Доведено, що в пероксисомах міститься білок NDR2 — серин/треонін-специфічна протеїн кіназа[en], що бере участь у розвитку війок.
Передбачається, що пероксисоми відіграють важливу роль у регуляції системного запалення, однак функціональна роль цих органел у запальній відповіді, яка опосередкована мієлоїдними імунними клітинами, значною мірою невідома.
У листках рослин пероксисоми беруть участь у процесі фотодихання. Цей процес є наслідком недостатньої специфічності головного ферменту, що фіксує вуглекислоту, — РФБК, яка може зв'язуватись не лише із вуглекислим газом, але й із киснем. У разі взаємодії кисню із рибулозо-1,5-біфосфатом під дією РБФК утворюється 3-фосфогліцерат і 2-фосфогліколат. Фотодихання є збитковим для клітини, позаяк фіксація вуглекислого газу в його ході не відбувається, але утворюється 2-фосфогліколат, засвоєння якого для клітини є енергетично невигідним. Окрім цього, в пероксисомах утворюється низка рослинних гормонів.
У рослин і деяких інших організмів у видозмінених пероксисомах — гліоксисомах — місяться ферменти гліоксилатного шляху. У ході цього процесу ацетил-КоА, що утворюється під час окиснення жирів (наприклад, запасених у насінні), перетворюється в гліоксисомі в чотиривуглецеву проміжну сполуку циклу лимонної кислоти — сукцинат, який виводиться до цитозолю та відтак використовується для синтезу цукрів.
У деяких найпростіших (наприклад, трипаносом) міститься особлива мембранопов'язана органела, що містить ферменти гліколізу — глікосома. Передбачається, що вона походить від пероксисоми.
У деяких грибів, таких як Aspergillus nidulans і Penicillium chrysogenum останній етап біосинтезу пеніциліну відбувається в пероксисомах. У A. nidulans і A. fumigatus пероксисоми залучені в синтезі сидерофорів. Окрім цього, тільця Вороніна сумчастих грибів, що слугують для закупорки пор пошкоджених клітин і відділення їх від нормальних клітин, є видозміненими пероксисомами.
Імпорт білків
ред.Позаяк пероксисоми не містять власної ДНК і рибосом, усі їхні білки синтезуються в ядрі та повинні імпортуватись усередину пероксисом із цитозолю. Деякі білки пероксисом скеровуються до них за участі C-кінцевого сигналу пероксимального адресування (PTS1). Послідовності PTS1 є значно коротшими за сигнали імпорту інших органел, і часто складаються всього з трьох амінокислотних залишків. Канонічна послідовність PTS1 містить серин, цистеїн або аланін, після якого йде залишок основної амінокислоти, а відтак лейцин. Наявність додаткових амінокислот поза PTS1 може посилювати адресний сигнал, особливо, якщо послідовність PTS1 сильно відрізняється від канонічної. Набагато рідше пероксисомні білки мають сигнальну послідовність PTS2, яка розміщена на N-кінці білка та має більшу довжину, ніж PTS1. PTS2 є частиною більшого пептиду, який відщеплюється після завершення імпорту. Процес імпорту білків до пероксисом вивчений недостатньо, але відомо, що в ньому залучені розчинні рецептори в цитозолі, які впізнають сигнальну послідовність, і білки докіну на поверненому до цитозолю боці пероксисом. Процес імпорту супроводжується гідролізом АТФ, і ньому беруть участь близько 23 різних білків, що називаються пероксинами[en]. Білки з PTS1 позиціонуються на пероксисомах за участі рецептора Pex5p, а з PTS2 — Pex7p. У ссавців адресування білків з PTS2 відбувається за участі білка, який є варіантом альтернативного сплайсинґу Pex5p. Комплекс із 6 різних пероксинів утворює мембранний транслокатор.
Процес імпорту білків пероксисом докорінно відрізняється від транслокації білків в ЕПР, мітохондрії та хлоропласти тому що білки пероксисом імпортуються після того, як вони набувають у цитозолі нативну чи навіть олігомерну структуру. З цього боку транспорт білків до пероксисом нагадує перенесення білків до ядра. Під час транспорту до ядра та до пероксисоми рецептор, що впізнає сигнальну послідовність, переноситься із субстратом через мембрану, відтак рецептор відділяється й експортується до цитозолю для подальшого використання.
Біогенез
ред.Механізм утворення нових пероксисом у клітині є предметом для дискусії. Достеменно невідомо, чи утворюються пероксисоми із попередніх шляхом їх росту та поділу (подібно до мітохондрій і пластидів), або ж вони утворюються шляхом відщеплення від ендоплазматичного ретикулуму. Скоріш за все, обидві точки зори можуть відповідати дійсності, а механізм біогенезу пероксисом, ймовірно, виглядає ось так. Серед білків пероксисом є такі, які спочатку інтегруються в мембрану ЕПР, де вони можуть входити до складу особливих везикул-попередників пероксисом. Відщеплення від ЕПР цих везикул і їхнє подальше злиття призводить до утворення пероксисоми, яка імпортує решту пероксисомальних білків за допомогою власного апарату імпорту. Відтак пероксисома може рости та ділитись із утворенням дочірніх пероксисом.
2017 року була запропонована нова модель утворення пероксисом de novo. Відомо, що пероксисоми та мітохондрії функціонують разом у багатьох метаболічних шляхах, як-от β-окиснення жирних кислот. Крім цього, за відсутності пероксисом у клітинах багато білків пероксинів імпортуються до мітохондрій. У зв'язку з цим передбачається, що пероксисоми є гібридним продуктом злиття пре-пероксисомних везикул, що відділились як від ЕПР, так і від мітохондрій.
Щодо походження пероксисом існує низка альтернативних гіпотез. Позаяк пероксисоми різних організмів містять низку білків, однакових для всіх, була запропонована гіпотеза ендосимбіотичного походження пероксисом. Відповідно до цієї гіпотези, пероксисоми походять від внутрішньоклітинних бактерій. Існує версія, що пероксисоми походять від актинобактерій. Втім, останнім часом ці гіпотези були спростовані.
Клінічне значення
ред.Першим захворюванням, для якого була встановлена пов'язана з пероксисомами причина, став синдром Зеллвеґера[en]. У пацієнтів із синдромом Зельвеґера порушений процес імпорту білків у пероксисоми, що призводить до важкої пероксисомної недостатності. Їх клітини містять «порожні» пероксисоми. Пацієнти страждають від важких порушень у ЦНС, печінці та нирках і помирають невдовзі після народження. Одна форма захворювання спричинена мутацією в пероксині Pex2, а дефект N-кінцевого сигналу імпорту зумовлює легшу форму захворювання.
З часу встановлення причин синдрому Зеллвеґера 1973 року було отримано багато нових свідчень про різноманітні захворювання, спричинені порушеннями функціонування пероксисом: станом на нині виявлено 14 генів, мутації яких призводять до пероксисомних розладів. Їх поділяють на дві групи: захворювання, спричинені порушеннями роботи одного ферменту, та захворювання, пов'язані з біогенезом пероксисом. До першої групи належать такі захворювання, як X-зчеплена адренолейкодистрофія[en] (АЛД) та різомелична точкова хондродисплазія[en] (РТХП) типів 2 та 3. У пацієнтів із X-зчепленою АЛД накопичуються жирні кислоти з дуже довгими алкільними ланцюгами через мутації в ABC-транспортері D1, який необхідний для транспорту цих сполук у пероксисоми. РТХП типів 2 та 3 спричинені дефектами двох основних ферментів біосинтезу плазмалогенів.
До другої групи належать хвороби, спричинені порушеннями біогенезу пероксиосом, тому вони характеризуються складнішою етіологією, ніж хвороби, спричинені порушеннями конкретних ферментів. До числа таких захворювань належить уже згаданий синдром Зеллвеґера, АЛД новонароджених, а також дитяча хвороба Рефсума[en]
Література
ред.| Вікісховище має мультимедійні дані за темою: Пероксисома |
- Molecular Machines Involved in Peroxisome Biogenesis and Maintenance / Cecile Brocard, Andreas Hartig. — Springer Vienna, 2014. — ISBN 978-3-7091-1788-0. — DOI: (англ.)
- Кассимерис Л., Лингаппа В. Р., Плоппер Д. . Клетки по Льюину. — М. : Лаборатория знаний, 2016. — 1056 с. — ISBN 978-5-906828-23-1. (рос.)
- Ченцов Ю. С. Введение в клеточную биологию. — М. : ИКЦ «Академкнига», 2005. — 495 с. — ISBN 5-94628-105-4. (рос.)
- Альбертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. Молекулярная биология клетки: в 3-х томах. Т. 2. — М.: Ижевск : НИЦ «Регулярная и хаотическая динамика», Институт компьютерных исследований, 2013. — 992 с. — ISBN 978-5-4344-0113-5. (рос.)
- Нельсон Д., Кокс М. Основы биохимии Ленинджера. — М. : БИНОМ. Лаборатория знаний, 2014. — Т. 2. — 636 с. — ISBN 978-5-94774-366-1. (рос.)
- ↑ Bonekamp, Nina A.; Völkl, Alfred; Fahimi, H. Dariush; Schrader, Michael (2009-7). Reactive oxygen species and peroxisomes: Struggling for balance. BioFactors (англ.). Т. 35, № 4. с. 346—355. doi:10.1002/biof.48. Процитовано 7 листопада 2019.
- ↑ Antonenkov, Vasily D. (1989). Dehydrogenases of the pentose phosphate pathway in rat liver peroxisomes. European Journal of Biochemistry (англ.). Т. 183, № 1. с. 75—82. doi:10.1111/j.1432-1033.1989.tb14898.x. ISSN 1432-1033. Архів оригіналу за 6 березня 2022. Процитовано 7 листопада 2019.
- ↑ Antonenkov, Vasily D. (1989-7). Dehydrogenases of the pentose phosphate pathway in rat liver peroxisomes. European Journal of Biochemistry (англ.). Т. 183, № 1. с. 75—82. doi:10.1111/j.1432-1033.1989.tb14898.x. ISSN 0014-2956. Процитовано 7 листопада 2019.
- ↑ а б в Wanders, Ronald J.A.; Waterham, Hans R. (2006-6). Biochemistry of Mammalian Peroxisomes Revisited. Annual Review of Biochemistry (англ.). Т. 75, № 1. с. 295—332. doi:10.1146/annurev.biochem.74.082803.133329. ISSN 0066-4154. Архів оригіналу за 12 листопада 2019. Процитовано 7 листопада 2019.
- ↑ Rhodin, J (1954). "Correlation of ultrastructural organization and function in normal and experimentally changed proximal tubule cells of the mouse kidney". Doctorate Thesis. Karolinska Institutet, Stockholm.
- ↑ Keller, G. A.; Gould, S.; Deluca, M.; Subramani, S. (1 травня 1987). Firefly luciferase is targeted to peroxisomes in mammalian cells. Proceedings of the National Academy of Sciences (англ.). Т. 84, № 10. с. 3264—3268. doi:10.1073/pnas.84.10.3264. ISSN 0027-8424. PMC 304849. PMID 3554235. Процитовано 7 листопада 2019.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Gould, S. J. (1 вересня 1988). Identification of peroxisomal targeting signals located at the carboxy terminus of four peroxisomal proteins. The Journal of Cell Biology (англ.). Т. 107, № 3. с. 897—905. doi:10.1083/jcb.107.3.897. ISSN 0021-9525. PMC 2115268. PMID 2901422. Процитовано 7 листопада 2019.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Karlson, Peter. (2005). Karlsons Biochemie und Pathobiochemie (вид. 15., komplett überarb. und neugestaltete Aufl). Stuttgart: Thieme. ISBN 3133578154. OCLC 181474420.
- ↑ Raven, Peter H.; Eichhorn, Susan E. (2006). Biologie der Pflanzen (вид. 4. Aufl). Berlin: De Gruyter. ISBN 9783110185317. OCLC 180904366.
- ↑ Feldmann, Horst (Cytologist) (2010). Yeast : molecular and cell biology. Weinheim: Wiley-VCH. ISBN 9783527326099. OCLC 489629727.
- ↑ а б в Alberts, Bruce,; Lewis, Julian,; Raff, Martin,; Roberts, Keith,; Walter, Peter, (2002). Molecular biology of the cell (вид. 4th ed). New York: Garland Science. ISBN 0815332181. OCLC 48122761. Архів оригіналу за 2 березня 2009. Процитовано 7 листопада 2019.
- ↑ а б Schrader, Michael; Kamoshita, Maki; Islinger, Markus (16 квітня 2019). Organelle interplay-peroxisome interactions in health and disease. Journal of Inherited Metabolic Disease (англ.). doi:10.1002/jimd.12083. Процитовано 7 листопада 2019.
- ↑ del Río, Luis A.; Sandalio, Luisa M.; Palma, JoséM.; Bueno, Pablo; Corpas, Francisco J. (1992-11). Metabolism of oxygen radicals in peroxisomes and cellular implications. Free Radical Biology and Medicine (англ.). Т. 13, № 5. с. 557—580. doi:10.1016/0891-5849(92)90150-F. Архів оригіналу за 17 листопада 2019. Процитовано 7 листопада 2019.
- ↑ Corpas, Francisco J.; Barroso, Juan B.; Carreras, Alfonso; Quirós, Miguel; León, Ana M.; Romero-Puertas, María C.; Esteban, Francisco J.; Valderrama, Raquel; Palma, José M. (2004-9). Cellular and Subcellular Localization of Endogenous Nitric Oxide in Young and Senescent Pea Plants. Plant Physiology (англ.). Т. 136, № 1. с. 2722—2733. doi:10.1104/pp.104.042812. ISSN 0032-0889. PMC 523336. PMID 15347796. Процитовано 7 листопада 2019.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) - ↑ Corpas, Francisco J; Barroso, Juan B; del Rı́o, Luis A (2001-4). Peroxisomes as a source of reactive oxygen species and nitric oxide signal molecules in plant cells. Trends in Plant Science (англ.). Т. 6, № 4. с. 145—150. doi:10.1016/S1360-1385(01)01898-2. Архів оригіналу за 17 листопада 2019. Процитовано 7 листопада 2019.
- ↑ Lismont; Revenco; Fransen (26 липня 2019). Peroxisomal Hydrogen Peroxide Metabolism and Signaling in Health and Disease. International Journal of Molecular Sciences (англ.). Т. 20, № 15. с. 3673. doi:10.3390/ijms20153673. ISSN 1422-0067. PMC 6695606. PMID 31357514. Архів оригіналу за 5 листопада 2019. Процитовано 7 листопада 2019.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання) Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Bednarek, P.; Pislewska-Bednarek, M.; Svatos, A.; Schneider, B.; Doubsky, J.; Mansurova, M.; Humphry, M.; Consonni, C.; Panstruga, R. (2 січня 2009). A Glucosinolate Metabolism Pathway in Living Plant Cells Mediates Broad-Spectrum Antifungal Defense. Science (англ.). Т. 323, № 5910. с. 101—106. doi:10.1126/science.1163732. ISSN 0036-8075. Процитовано 7 листопада 2019.
- ↑ Dixit, Evelyn; Boulant, Steeve; Zhang, Yijing; Lee, Amy S.Y.; Odendall, Charlotte; Shum, Bennett; Hacohen, Nir; Chen, Zhijian J.; Whelan, Sean P. (2010-5). Peroxisomes Are Signaling Platforms for Antiviral Innate Immunity. Cell (англ.). Т. 141, № 4. с. 668—681. doi:10.1016/j.cell.2010.04.018. Архів оригіналу за 13 лютого 2020. Процитовано 7 листопада 2019.
- ↑ Di Cara, Francesca; Bülow, Margret H.; Simmonds, Andrew J.; Rachubinski, Richard A. (2018-11). Subramani, Suresh (ред.). Dysfunctional peroxisomes compromise gut structure and host defense by increased cell death and Tor-dependent autophagy. Molecular Biology of the Cell (англ.). Т. 29, № 22. с. 2766—2783. doi:10.1091/mbc.E18-07-0434. ISSN 1059-1524. PMC 6249834. PMID 30188767. Архів оригіналу за 5 листопада 2019. Процитовано 7 листопада 2019.
{{cite news}}: Обслуговування CS1: Сторінки з PMC з іншим форматом (посилання)