Сульфатна кислота
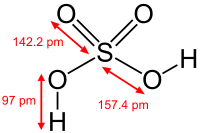
Сульфа́тна кислота́ (сірчана кислота, IUPAC — дигідрогенсульфат, застаріла назва — купоросна олія) — сполука сірки з формулою H2SO4. Безбарвна масляниста, дуже в'язка і гігроскопічна рідина. Сірчана кислота — одна з найсильніших неорганічних кислот і є дуже їдкою та небезпечною. Ця кислота утворює два ряди солей: сульфати і гідрогенсульфати, в яких у порівнянні з сульфатною кислотою замінюються два або один атоми водню на катіони металів. Сірчана кислота є однією з найважливіших технічних речовин у світі і лідирує за кількістю виробництва. Її використовують переважно у формі водних розчинів для виробництва добрив, як каталізатор в органічних синтезах, а також у виробництві інших неорганічних кислот.
| Сульфатна кислота | |
|---|---|

| |
| |
| Інші назви | Купоросне масло |
| Ідентифікатори | |
| Номер CAS | 7664-93-9 |
| Номер EINECS | 231-639-5 |
| DrugBank | DB11309 |
| KEGG | D05963 і C00059 |
| ChEBI | 26836 |
| RTECS | WS5600000 |
| SMILES | OS(O)(=O)=O[1] |
| InChI | InChI=1S/H2O4S/c1-5(2,3)4/h(H2,1,2,3,4) |
| Номер Бельштейна | 2037554 |
| Номер Гмеліна | 2122 |
| Властивості | |
| Молекулярна формула | H2SO4 |
| Молярна маса | 98,08 г/моль |
| Зовнішній вигляд | Прозора оліїста рідина |
| Густина | 1,8356 г/см³ |
| Тпл | 10,38 °C |
| Ткип | 279,6 °C 296,2°C* ( 100% ) 336,5°C* ( 98,3% ) 268,9°C* ( 90% ) 210,2°C* ( 80% ) 141,8°C* ( 60% ) *760тор [2] |
| Небезпеки | |
| Класифікація ЄС | |
| S-фрази | (S1/2) S26 Шаблон:S30 S45 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Історія
ред.Сульфатна кислота (або стара назва — купоросна олія) була відома з давніх часів. Перші згадки про неї можна знайти в текстах алхіміка Джабіра ібн Хайяна 8-го століття. Можливі методи виробництва описані в працях Альберта Великого (1200–1280) і Василя Валентина (1600). В основі цього методу лежить утворення кислоти з хальканинту та галунів. Застаріла назва походить від застарілої назви мінералів з яких вона отримувалася — купороси. Перші наукові дослідження за допомогою сірчаної кислоти провів Йоганн Рудольф Глаубер. Він провів реакцію між сірчаною кислотою і сіллю та отримав соляну кислоту і сіль, яка була названа на його честь — глауберова сіль[3]. Методи, у яких використовували сульфати, були дуже складними і дорогими. Для отримання великих кількостей цієї речовини в 18-му столітті розробили процес, в якому використовували спалення сірки й селітри у скляній тарі. Через те, що скляні посудини були дуже крихкими, перша реакція була проведена в 1746 році Джоном Робаком у свинцевих контейнерах. Сірчана кислота створена методом Джона Робака мала концентрацію тільки 35–40 %. Пізніше покращення методу французьким хіміком Жозефом Луї Гей-Люссаком і англійським Джоном Гловером дало вихід речовини 78 % концентрації. Тим не менше, виробництво деяких барвників та інших хімічних речовин вимагає концентрованішого продукту. Протягом 18-го століття сірчана кислота отримувалася сухою перегонкою мінералів, процес схожий на оригінальні алхімічні процеси. Пірит (дисульфід заліза, FeS2) нагрівали в повітрі для отримання сульфату заліза (ІІ), FeSO4, який окислюється при подальшому нагріванні до сульфату заліза (ІІІ) Fe2(SO4)3, який, при нагріванні до 480 °С, розкладається до оксиду заліза (ІІІ) і триоксида сірки, який може бути використаний для отримання сірчаної кислоти в будь-якої концентрації. 1831 року британський купець Перегрін Філліпс запатентував контактний процес, який був набагато економічніший. Сьогодні майже вся сірчана кислота у світі виробляється з використанням цього методу.
Знаходження в природі
ред.Земля
ред.Вільна сірчана кислота зустрічається в природі дуже рідко. В атмосфері вона утворюється з діоксиду сірки, який утворюється при згоранні сірковмісних речовин або вулканічних вивержень. Діоксид сірки окислюється гідроксильними радикалами та киснем з утворенням триоксиду сірки, який вступаючи в реакцію з атмосферною вологою утворює кислоту. У кислотних дощах вона виступає в розбавленому виді. Невелику кількість вільної сірчаної кислоти також можна знайти в деяких вулканічних джерелах, які називаються сольфатари. Найбільшу кількість сірчаної кислоти у світі містить озеро в кратері вулкана Іджен в Індонезії. На відміну від вільної кислоти, її солі, зокрема, сульфати, зустрічається в природі набагато частіше. Існує багато різних мінералів сульфатів. Серед них найвідомішими й найважливішими є гіпс (CaSO4 · 2 H2O), барит (BaSO4), халькантит (CuSO4 · 5 H2O) і глауберова сіль (Na2SO4 · 10 H2O).
Знаходження поза межами землі
ред.Сірчана кислота поза межами Землі знаходиться в верхніх шарах атмосфери Венери. Вона утворюється в результаті фотохімічних реакцій діоксиду сірки і води, які утворюють краплі 80–85 % кислоти. У глибших шарах кислота розпадається через високі температури знову на діоксид сірки, і воду, які піднімаючись догори знову можуть утворювати сірчану кислоту.[4] Інфрачервоні спектри які були отримані апаратом Галілео показують різні ступені поглинань на супутнику Юпітера, які були віднесені до одного або кількох видів гідратів сульфатної кислоти.[5]
Виробництво
ред.Сировиною для виробництва сірчаної кислоти є елементарна сірка, яку отримують в величезних кількостях на нафто- та газопереробних заводах, з сірководню, за допомогою процесу, який знаний як процес Клауса. Потім сірку окислюють до діоксиду сірки:
- Реакція сірки з киснем
Ще одним джерелом діоксиду сірки є виплавлення руд, що містять сірку. Прикладами є мідні, цинкові і свинцеві сульфіди. Діоксид сірки утворюється при випаленні з киснем повітря.
- Реакція під час випалу сульфіду цинку
У 1999 році в Європі було випалено близько 3 млн тонн піриту для виробництва сульфатної кислоти. В Азії ця цифра більша, оскільки і запаси його більші.[6] Для бідних ресурсами країнах, які не мають ні сірки, ні сульфідних руд, існує процес Мюллера-Кюне. В цьому процесі діоксид сірки утворюється при випаленні гіпсу і вугілля в печі. Цей процес можна зробити прибутковішим, якщо в піч додавати пісок і глину для утворення цементу як побічного продукту. Для подальшого виробництва знадобиться сірчаний ангідрид. При низьких температурах реакція проходить повільно, оскільки вимагає порівняно рідкісних в газовій фазі потрійних зіткнень, а при високих рівновага зміщена в бік розкладу сірчаного ангідриду, тому для проведення цієї реакції потрібні каталізатори. На ранніх порах використовували платину, пізніше перейшли на ванадієвий ангідрид V2O5 або ванадати лужних металів KVO3. В[7] як каталізатор згадується Fe2O3 з домішкою CuO утворені в результаті випалювання сульфідної руди (температура каталізу нижча за температуру відпалу, тому каталізатор існуватиме в формі суміші сульфатів). В більш пізніх виданнях цього автора такий каталізатор не згадується, зате у виданнях, мабуть, всіх років приводиться порівняння залежності каталітичної ефективності від температури для Pt, Ag3VO4 та V2O5. Ефективність зростає з ціною каталізатора (каталіз гетерогенний, отже швидкість реакції віднесена до одиниці поверхні; каталізатор в таких процесах стараються зробити якомога більш дрібнозернистим).
- Окиснення діоксиду сірки до триоксиду
Триоксид сірки не розбавляється у воді відразу ж: через занадто бурхливу початкову реакцію в контакті з водою утворюється плівка туману сульфатної кислоти, що перешкоджає подальшій реакції. Спочатку його вводять у концентровану сірчану кислоту, цей розчин називають — олеумом. Потім олеум розчиняють у воді до утворення сірчаної кислоти.
- Розчинення сірчаного ангідриту в концентрованій сірчаній кислоті з утворення дисульфатної кислоти
- Розчинення дисульфатної кислоти у воді
В останні роки виробництво сірчаної кислоти зросло, переважно, в Китаї, у той час як в європейських країнах, виробництво скоротилося.
В домашніх умовах невеликі кількості розведеної сульфатної кислоти можна отримати електролізом розчину мідного купоросу із свинцевим анодом (напруга має бути вищою за 2 В через велику перенапругу виділення кисню на двоокисі свинцю, який утворюється на поверхні аноду, але не більше 5 В, щоб не перегрівати).
Фізичні властивості
ред.100 %-ва сірчана кислота («моногідрат») при кипінні втрачає SO3 та невелику кількість води з утворенням 98,3 % кислоти (азеотропна суміш). 98 % кислота є стабільнішою при зберіганні, і зазвичай також називається концентрованою. Інші концентрації використовують для різних цілей. Дані про різні концентрації:
| Масова частка H2SO4 |
Щільність (кг/л) |
Концентрація (моль/л) |
Назва |
|---|---|---|---|
| 10 % | 1,07 | ~1 | Розведена сульфатна кислота |
| 29-32 % | 1,25-1,28 | 4,2-5 | акумуляторна кислота (використовують у свинцево-кислотних акумуляторних батареях) |
| 62-70 % | 1,52-1,60 | 9,6-11,5 | Фотопаратна кислота Добривна кислота |
| 78-80 % | 1,70-1,73 | 13,5-14 | Вежова кислота Гловерова кислота |
| 95-98 % | 1,83 | ~18 | Концентрована сульфатна кислота |
Хімічно чиста сульфатна кислота є важкою безбарвною маслянистою рідиною. Продають, зазвичай, 96,5 % водний розчин густиною 1,84 г/см³ або так званий «олеум», тобто розчин SO3 в H2SO4. У воді H2SO4 розчиняється дуже добре (змішується з водою в необмежених кількостях). При цьому виділяється тепло, і розчин дуже сильно нагрівається (навіть до кипіння води). Тому при додаванні води до концентрованої сульфатної кислоти остання розбризкується внаслідок швидкого перетворення води в пару. Через це при розведенні концентрованої H2SO4 треба кислоту вливати у воду (а не навпаки!) тонким струменем при старанному розмішуванні розчину скляною паличкою. Концентрована сульфатна кислота як і чиста вода погано проводить струм внаслідок малої дисоціації, питома електропровідність 1,044·10−2 S/см
Полярність і провідність
ред.Безводна H2SO4 є дуже полярною рідиною, діелектрична проникність якої становить близько 100. Вона має високу електропровідність, спричинену дисоціацією через самопротонування, процес, знаний як автопротоліз[8]:
Хімічні властивості
ред.З неорганікою
ред.Дисоціація у водному розчині йде в декілька етапів:
- Перший етап дисоціації;K1 = 2.4 x 106 (сильна кислота)
Це значення кислотності взяте як основне при визначенні суперкислот.
- Друга стадія дисоціації;K2 = 1.0 x 10−2
Сульфатна кислота руйнує також багато органічних речовин, зокрема вуглеводи — дерево, папір, бавовняні тканини, цукор тощо. Руйнування цих речовин обумовлюється тим, що концентрована сульфатна кислота віднімає від них водень і кисень у вигляді води, а вуглець залишається у вигляді пористого вугілля.
Реакції з металами
ред.При дії розведеної сульфатної кислоти на метали, які у електрохімічному ряді активності металів розташовані ліворуч водню, виділяється водень. Концентрована сірчана кислота має сильний окислювальний ефект і здатна реагувати, при нагріванні, навіть з благородними металами, такими як мідь, ртуть і срібло, хоча при цьому вона не взаємодіє з залізом та деякими іншими металами через їх пасивацію. Тому для перевезення концентрованої сульфатної кислоти використовують залізні цистерни.
- Реакція міді з концентрованою сульфатною кислотою
Кислотно-основні властивості
ред.Сірчану кислоту також можна використовувати для витіснення слабших кислот з їх солей. Реакція з ацетатом натрію, наприклад, витісняє оцтову кислоту CH3COOH і утворює бісульфат натрію:
Подібним чином можна використовувати реакцію сірчаної кислоти з нітратом калію для отримання азотної кислоти та осаду гідросульфату калію. У поєднанні з азотною кислотою сірчана кислота діє і як кислота, і як дегідратуючий агент, утворюючи нітрит-іон , що важливо в реакціях нітрування, які включають електрофільне ароматичне заміщення. Цей тип реакції, де протонування відбувається на атомі кисню, важливий у багатьох реакціях органічної хімії, таких як етерифікація Фішера та дегідратація спиртів.
Коли сірчана кислота вступає в реакцію з суперкислотами, вона може діяти як основа і може протонуватися, утворюючи іон [H3SO4]+. Солі [H3SO4]+ були отримані за допомогою такої реакції в розчині HF: [(CH3)3SiO]2SO2 + 3 HF + SbF5 → [H3SO4]+[SbF6]− + 2 (CH3)3Si
Вищевказана реакція є термодинамічно сприятливою завдяки високій ентальпії зв'язку Si–F у побічному продукті. Проте протонування за допомогою просто фторстимонової кислоти виявилося невдалим, оскільки чиста сірчана кислота піддається самоіонізації з утворенням іонів [H3O]+:
2H2SO4 ⇌ [H3O]+ + [HS2O7]−
що перешкоджає перетворенню H2SO4 в [H3SO4]+ системою HF/SbF5[9]
Реакції з вуглецем і сіркою
ред.Гаряча концентрована сірчана кислота окислює вуглець[10] (як бітумне вугілля) і сірку:
Реакція з натрій хлоридом
ред.Кислота реагує з натрій хлоридом з утворенням газоподібного хлористого водню і бісульфату натрію
Визначення сульфат іону
ред.Якісна реакція на сульфат іон : [11]
В результаті реакції утворюється білий кристалічний осад сульфату барію[12]
Реакції з органікою
ред.Електрофільне ароматичне заміщення
ред.Бензол зазнає електрофільного ароматичного заміщення сірчаною кислотою з утворенням відповідних сульфокислот:
Реакція осадження білків
ред.Сульфатна кислота осаджує білки. У надлишку концентрованої сульфатної кислоти руйнуються молекули білка до найпростіших низькомолекулярних сполук, які не дають осаду. У надлишку концентрованої сульфатної кислоти руйнуються молекули білка до найпростіших низькомолекулярних сполук, які не дають осаду.[13][14]
Взаємодія зі спиртами
ред.Реакцію між сірчаною кислотою та спиртами загалом, можна представити таким загальним рівнянням:
Однак продукти реакції залежать від зовнішніх умов реакції. Як показано на прикладі нижче.[15]
Взаємодія з алканами
ред.Реакція між сірчаною кислотою та алканами може призвести до кількох продуктів залежно від умов і залучених реагентів. Приклади:
Дегідратація алканів
ред.Сірчана кислота може діяти як дегідратуючий агент і видаляти молекули води з алканів для отримання алкенів. Загальне рівняння цієї реакції таке:
У цьому рівнянні RH являє собою молекулу алкану, яка втрачає молекулу води з утворенням алкілгідросульфату (R-HSO4) і алкену (R=CH2)[15]
Сульфування алканів
ред.Сульфатна кислота також може реагувати з алканами в присутності повітря або кисню з утворенням алкілсульфокислот. Загальне рівняння реакції:
Галогенування алканів
ред.Сірчану кислоту можна використовувати як каталізатор для галогенування алканів, такими як хлор або бром. Загальне рівняння:
RH це молекулу алкану, X — атом галогену, який реагує з алканом у присутності сірчаної кислоти з утворенням алкілгалогеніду (RX), галогеніду водню (HSO4X) і води.[15]
Застосування
ред.Сірчана кислота є дуже важливим товаром хімічної промисловості і є індикатором її промислової потужності.[16][17] Світове виробництво в 2004 році становило близько 180 млн тонн, при такому географічному розподілі: Азія 35 %, Північна Америка 24 %, Африка 11 %, Західна Європа 10 %, Східна Європа і Росія 10 %, Австралія і Океанія 7 %, Південна Америка 7 %.[18] Більша частина виробленої кислоти (~60 %) витрачається на виробництво добрив, суперфосфату, фосфату амонію, сульфатів, сульфату амонію. Близько 20 % використовують у хімічній промисловості для виробництва миючих засобів, синтетичних смол, барвників, фармацевтичних препаратів, інсектицидів, антифризу, а також для різних технічних процесів. Близько 6 % використовують для виробництва пігментів, фарб, емалей, типографських фарб. Використовують також як осушувач газів.
Електроліт
ред.Сірчана кислота діє як електроліт в свинцево-кислотних акумуляторах: На негативному електроді :
На позитивному електроді:
Загалом:
Каталізатор
ред.Сірчану кислоту використовують також для інших цілей в хімічній промисловості. Наприклад, вона є кислотним каталізатором для перетворення циклогексанону оксиму в капролактам, який використовують для виготовлення капрону. Її використовують для виготовлення соляної кислоти з солі. Сульфатну кислоту використовують у нафтопереробній промисловості, як каталізатор реакції ізобутану та ізобутилену, для утворення ізооктану, сполуки, що має еталонне октанове число, і придатної для створення високооктанового бензину без металовмісних присадок.
Водопідготовка
ред.Сірчану кислоту як і соляну можуть використовувати для підкислення води, особливо у замкнених контурах для зменшення відкладення карбонату кальцію. Також, сірчану кислоту використовують для виробництва сульфовугілля та для регенерації катіонообмінних смол.[19]
Промислове виробництво хімічних речовин
ред.Основне використання сірчаної кислоти — «мокрий спосіб» для виробництва фосфорної кислоти, яку використовують для виробництва фосфорних добрив. У цьому методі використовують фосфорит, і щорічно переробляють понад 100 мільйонів тонн. Ця сировина представлена нижче як фторапатит, хоча точний склад може відрізнятися. Його обробляють 93 % сірчаною кислотою для отримання сульфату кальцію, фтористого водню і фосфорної кислоти. HF видаляється у вигляді плавикової кислоти. Загальний процес можна представити так:
Сульфат амонію, важливе азотне добриво, найчастіше виробляється як побічний продукт коксохімічних заводів, що постачають металургійні та сталеливарні заводи. Реакція аміаку, що утворюється в результаті термічного розкладання вугілля, з відпрацьованою сірчаною кислотою дозволяє кристалізувати аміак у вигляді солі (часто коричневого кольору через забруднення залізом) і продавати його агрохімічній промисловості. Альтернативно, газуватий аміак впорскується до концентрованої (понад 70 %) сульфатної кислоти і в результаті утворюються кристали солі розміром 0,5–3 мм:
Інше важливе застосування сірчаної кислоти — це виробництво сульфату алюмінію. Сульфат алюмінію отримують реакцією бокситу з сірчаною кислотою:
Сірчана кислота також важлива у виробництві розчинів барвників.
Промисловий засіб для чищення
ред.Сірчану кислоту використовують у великих кількостях у металургійній промисловості для видалення окислення, іржі та накипу з листового прокату.
Отримання
ред.Сірчану кислоту виробляють із сірки, кисню та води за допомогою або традиційного контактного методу (виробничий), або мокрого методу виробництва.
Контактний метод (промисловий)
ред.У промисловості сірчану кислоту отримують окисленням сірки до сірчистого газу. Сірку беруть елементарну, або сірчаний колчедан, або сірководневовмісні гази.
Сірчистий газ окиснюють до триоксиду (сірчаного ангідриду) на твердому ванадієвому каталі (дана реакція екзотермічна, тому застосовується проміжне охолодження після першого шару за допомогою трубних пучків, через які подається повітря,
Після наступних двох ступенів — за допомогою кільцевої труби, що має великий діаметр, через яку подається повітря, над якою розташований дефлектор.
Триоксид сірки поглинається 97–98 % H2SO4 з утворенням олеуму (H2S2O7), також відомого як димляча сірчана або піросірчана кислота. Потім олеум розбавляють водою з утворенням концентрованої сірчаної кислоти.
Сірчану кислоту, яку одержують таким способом, також називають «контактною» (концентрація 92–94 %).
Мокрий метод
ред.На першому етапі сірка спалюється для отримання діоксиду сірки:
або, ж, сірководень спалюється до газу діоксиду сірки:
Потім діоксид сірки окислюється до триоксиду сірки за допомогою кисню з оксидом ванадію (V) як каталізатором.
Триоксид сірки гідратується в сірчану кислоту:
Останнім етапом є конденсація сірчаної кислоти до рідкої 97–98 % H2SO4 :
Пряме розчинення SO3 у воді (мокрий метод), рідко практикується, оскільки реакція є надзвичайно екзотермічною, що призводить до утворення гарячого аерозолю сірчаної кислоти, який потребує конденсації та відділення.
Нітрозний спосіб
ред.Окислення діоксиду сірки діоксидом азоту у присутності води. Саме у такий спосіб відбулася реакція у повітрі Лондона під час Великого смогу.
Інші способи
ред.Метасульфітний спосіб
ред.Менш відомим методом є метабісульфітний метод, при якому метабісульфіт поміщають на дно склянки та додають соляну кислоту 12,6 молярної концентрації. Отриманий газ пропускають через азотну кислоту, яка вивільняє коричневі/червоні пари діоксиду азоту під час реакції. Про завершення реакції свідчить припинення виділення диму. При такому способі не утворюється туман, що досить зручно:
З використанням хлоридів металів
ред.Спалювання сірки разом із селітрою (нітрат калію, KNO3) у присутності пари. Коли селітра розкладається, вона окислює сірку до SO3, який з'єднується з водою, утворюючи сірчану кислоту. Як альтернатива, розчинення діоксиду сірки у водному розчині солі металу-окислювача, такого як хлорид міді (II) або заліза (III):
Електролітичний метод
ред.Два менш відомі лабораторні методи виробництва сірчаної кислоти, хоча й у розведеній формі та потребують додаткових зусиль для очищення. Розчин мідного купоросу можна електролізувати за допомогою мідного катода та платинового/графітового анода з утворенням губчастої міді на катоді та виділенням кисню на аноді. Розчин розбавленої сульфатної кислоти вказує на завершення реакції, коли він перетворюється на синій до прозорого (утворення водню на катоді є ще однією ознакою):
Електробромний метод
ред.Більш дорогим, небезпечним і складним, але новим є електробромний метод, який використовує суміш сірки, води та бромистоводневої кислоти як електролітичного розчину. Сірка виштовхується на дно контейнера під розчин кислоти. Потім мідний катод і платиновий/графітовий анод використовують з катодом біля поверхні, а анод розташовується в нижній частині електроліту для подачі струму. Це може тривати довше та виділяє токсичні пари брому/броміду сірки, але реагентна кислота підлягає переробці. Загалом лише сірка та вода перетворюються на сірчану кислоту та водень (без втрат кислоти у вигляді парів)
— (електроліз водного розчину бромистого водню)
Br2 + Br− ↔ Br−3 — (початкове виробництво триброміду, з часом змінюється у міру виснаження Br−)
— (бром реагує з сіркою з утворенням диброміду сірки)
— (окислення та гідратація диброміду сірки)
Екзотичні методи
ред.У лабораторних умовах можна отримати сірчану кислоту взаємодією сірководню, елементарної сірки та діоксиду сірки з хлорною або бромною водою або пероксидом водню:
З бромоводнем
ред.
З хлороводнем
ред.
З пероксидом водню
ред.
Також її можна отримати взаємодією діоксиду сірки з киснем та водою при +70 °C, під тиском, у присутності сульфату міді (II)
Безпека
ред.Сірчана кислота їдка, хоча через значну в'язкість опік може статись за час, достатній для змивання кислоти, що потрапила на шкіру. В цьому сенсі небезпечніші олеум та хлорсульфонова кислота, які можуть швидко спричинити сильні опіки. За корозійними властивостями менш небезпечна, ніж соляна чи азотна кислоти, оскільки менш летка і не дуже активний окисник при звичайних температурах. Найнебезпечніше потрапляння на відкриті слизові оболонки. Потрапляння в очі може статись при спробі розбавлення концентрованої кислоти доливанням до неї води (пряме порушення правил поводження з концентрованою сульфатною кислотою), при цьому вода закипає і розбризкується разом з кислотою. Вражені ділянки промивають великою кількістю води і 5 % розчином питної соди.
Примітки
ред.- ↑ sulfuric acid — EBI.
- ↑ "Справочник химика" , 3-Т , 2-ге вид.,1965р.
- ↑ Walter Jansen: Zum Gedenken: Johann Rudolph Glauber, in: Chemikon, 2004, 11, 3, S. 155; DOI:10.1002/ckon.200490022.
- ↑ V. A. Krasnopolsky, V. A. Parshev: Chemical composition of the atmosphere of Venus, in: Nature, 1981, 292, S. 610-613; DOI:10.1038/292610a0.
- ↑ Orlando, T. M.; McCord, T. B.; Grieves, G. A. (2005). The chemical nature of Europa surface material and the relation to a subsurface ocean. Icarus (journal). 177 (2): 528—533. Bibcode:2005Icar..177..528O. doi:10.1016/j.icarus.2005.05.009.
- ↑ E. R. Riegel und J. A. Kent: Riegel's Handbook of Industrial Chemistry. Springer 2003. ISBN 0-306-47411-5, S. 503.
- ↑ Некрасов Б.В. Основы общей химии. — М. : «Химия», 1965. — Т. 1-й. (рос.)
- ↑ Greenwood, Norman N., Alan (1997). Chemistry of the Elements (Англійська) . Butterworth-Heinemann. ISBN ISBN 978-0-08-037941-8..
{{cite book}}: Перевірте значення|isbn=: недійсний символ (довідка) - ↑ Housecroft, Catherine E.; Sharpe, Alan, G. (2008). Chapter 16: The group 16 elements Inorganic Chemistry, 3rd Edition (англійська) . Pearson. с. p. 523. ISBN 978-0-13-175553-6..
{{cite book}}:|pages=має зайвий текст (довідка); Перевірте значення|isbn=: недійсний символ (довідка) - ↑ Kinney, Corliss Robert; Grey,, V. E (28 квітня 2017). Reactions of a Bituminous Coal with Sulfuric Acid (PDF). https://web.archive.org/ (англійська) . Pennsylvania State University. Архів оригіналу (PDF) за 28 квітня 2017. Процитовано 18.03.2023. [Архівовано 2017-04-28 у Wayback Machine.]
- ↑ Якісна реакція на сульфат-іони — урок. Хімія, 9 клас. miyklas.com.ua (укр.). Процитовано 25 березня 2023.
- ↑ Хімія - 033. Якісна реакція на сульфат і сульфіт іони. sites.google.com (укр.). Процитовано 25 березня 2023.
- ↑ Яцков, Мисіна,, М.В. О.І. (5.06.19). МЕТОДИЧНІ ВКАЗІВКИ до виконання лабораторних робіт з курсу „Хімія з основами біогеохімії” (тематичний розділ „Основи біогеохімії”) (PDF). https://ep3.nuwm.edu.ua (українська) . Національний університет водного господарства та природокористування. Процитовано 25.03.2023.
- ↑ 7 Додавання сульфатної кислоти (укр.), процитовано 25 березня 2023
- ↑ а б в г Theodore L. Brown, H. Eugene LeMay Jr., Bruce E. Bursten, Catherine Murphy,, Patrick Woodward, Steven Langford, Dalius Sagatys, Adrian George (2013). Chemistry: The Central Science (Англійська) . AU: Pearson Higher Education ,. с. 1359. ISBN 9781442559462.
- ↑ Chenier, Philip J. (1987). Survey of Industrial Chemistry. New York: John Wiley & Sons. с. 45–57. ISBN 0471010774.
- ↑ «Цікава хімія», М. Д. Василега, К., «Радянська школа» , 1980
- ↑ Davenport, William George and King, Matthew J. (2006). Sulfuric acid manufacture: analysis, control and optimization. Elsevier. с. 8, 13. ISBN 978-0-08-044428-4. Архів оригіналу за 27 травня 2013. Процитовано 23 грудня 2011.
- ↑ В.О.Шадура; Н.В.Кравченко (2018). Водопостачання та водовідведення (PDF). с. 183-184. Архів оригіналу (PDF) за 8 серпня 2021. Процитовано 8 серпня 2021.
{{cite book}}: Вказано більш, ніж один|pages=та|page=(довідка) - ↑ Сульфат амонію. Вікіпедія (укр.). 31 січня 2023. Процитовано 1 квітня 2023.
Література
ред.- Глосарій термінів з хімії / укладачі: Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
Посилання
ред.- Сірчана кислота // Універсальний словник-енциклопедія. — 4-те вид. — К. : Тека, 2006.
- КИСЛОТА СІРЧАНА [Архівовано 16 березня 2016 у Wayback Machine.] //Фармацевтична енциклопедія
- КИСЛОТА СУЛЬФАТНА [Архівовано 16 березня 2016 у Wayback Machine.] //Фармацевтична енциклопедія