Яйцеклітина
Ооци́т, також овоци́т (від грец. ōón — яйце, грец. kýtos — клітина), яйцекліти́на — жіноча статева клітина оогамних видів. Зливаючись зі сперматозоїдом, утворює і забезпечує розвиток зиготи, з якої формується ембріон. Нерухома та велика навіть у порівнянні з іншими клітинами організму, це високоспеціалізована клітина, оболонки якої пропускають лише один зі сперматозоїдів всередину, а вміст і накопичені поживні речовини (жовток) формують полярність майбутнього зародка.
| Яйцеклітина | |
 |
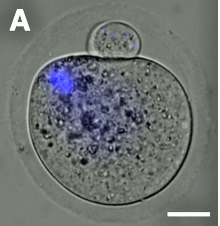
Ооцит формується в багато стадій, мейоз та дозрівання, з відповідними назвами, «яйцеклітина» вживається починаючи з первинного ооцита й до запліднення[1] (див. стадії оогенезу).
Лише оогамні види зі статевим розмноженням утворюють ооцити та сперматозоїди. У ізогамних видів (наприклад, у пивних дріжджів) гамети однакові за формою та рухливістю.
Історія відкриття
ред.Запліднення й розвиток ембріона досліджувались задовго до формування наукового методу. Було зрозуміло, що новий організм формується після статевого акту, але внесок жіночого й чоловічого батьківських організмів упродовж історії людства вважався різним. Гіппократ (V-IV ст. до н. е.) вважав, що обидва батьки вкладають рівноцінні частки, які формують ембріон у матці матері, тоді як Арістотель думав, що мати лише надає місце для розвитку ембріона, а весь матеріал зародка йде від батька. Погляд Арістотеля домінував аж до XVII століття. Тоді внесок у розвиток медицини, зокрема, ембріології, зробили Вільям Гарвей, Ян ван Горн (нід. Jan van Horne), Ян Сваммердам, Ніколас Стено, Реньє де Грааф та Франческо Реді. Результатом їхньої роботи стала теорія, що всі самиці, зокрема, й людини, продукують яйцеклітини. Вільяму Гарвею приписують і авторство фрази «все від яйця» (лат. ex ovo omnia)[2].
1677 року Антоні ван Левенгук сконструював мікроскоп, за допомогою якого вивчав, зокрема, чоловічу сперму й уперше побачив сперматозоїди. Так було встановлено наявність як чоловічих, так і жіночих статевих клітин, але роль кожної з них в утворенні зародка дискутувалась ще приблизно 200 років (див. преформізм). І лише на початку ХІХ століття Маттіас Шлейден та Теодор Шванн з'ясували, що як сперматозоїд, так і яйцеклітина однаково необхідні для формування зародка. Цьому твердженню сприяла встановлена Карлом фон Бером під мікроскопом наявність яйцеклітини ссавців. 1876 року Оскар Гертвіг[en] вперше спостерігав запліднення морських їжаків і встановив, що ядра сперматозоїда і яйцеклітини зливаються під час запліднення[2]. Едуард ван Бенеден[en] наприкінці 19 сторіччя описав дозрівання яйця до стадії бластоцисти, а Йоганес Соботта[en] опублікував детальну роботу про утворення ооцита, запліднення та поділ мишачого ембріона[3].
Будова
ред.Будова яйцеклітини варіює у різних організмів. Відмінності можуть проявлятися на всіх таксономічних рівнях, від класових до видових особливостей. На будову яйцеклітини значно впливають характерні риси середовища, де вона очікуватиме запліднення, та стратегія розмноження виду загалом. Від цих чинників залежить розмір яйцеклітини, будова оболонок, розміщення в цитоплазмі різних факторів тощо. Нижче наведено узагальнені особливості будови яйцеклітини з деякими конкретними прикладами.
Розміри яйцеклітин дуже сильно варіюють в залежності від класу тварин. У плацентарних ссавців розміри яйцеклітини на стадії Граафівського пухирця, коли ріст вже завершився і яйцеклітина готова до овуляції, коливають від 60—130 мкм у діаметрі[4] тоді як у птахів розміри яєць дуже великі — у страуса яйце важить в середньому 1,45—1,65 кг.[5]. Тому саме ці птахи мають найбільші абсолютні розміри яйцеклітин серед усіх живих організмів. У морського їжака розміри жіночих гамет середні, об'єм яйцеклітини складає 2×10−4 мм3, що перевищує об'єм сперматозоїда на 4 порядки[6].
Під час запліднення ооцит надає половину генетичного матеріалу зародка, іншу половину приносить сперматозоїд. Але яйцеклітина містить майже всю цитоплазму майбутньої зиготи — сперматозоїд забезпечує лише центросому чи її частини (див. розділ «редукція центросоми»). Тому склад ооцита й розміщення в його цитоплазмі різних РНК та білків мають велике значення для ембріогенезу[7].
Цитоплазма яйцеклітини, ооплазма, містить велику кількість наступних речовин[6]:
- РНК, як мРНК що накопичуються та будуть використані задля біосинтезу білків на різних стадіях оогенезу чи після запліднення, також різних видів некодуючих РНК, які виконують різноманітні функції;
- білків, роль яких полягає у забезпеченні поживних та захисних функцій, також у впливі на подальшу диференціацію клітин зародку під час дроблення й гаструляції;
- факторів транскрипції;
- специфічних везикул: базальних, апікальних, кортикальних та ехінонектинових (англ. echinonectin), призначення яких полягає в захисті яйцеклітини від поліспермії — потрапляння до клітини більше, ніж одного сперматозоїда (див. розділ «запліднення»)
- поживних речовин: жовток;
- захисних речовин:
- антитіл (у птахів);
- речовин, що захищають від ультрафіолетового випромінювання, таких, як мікоспорин-подібні амінокислоти[en];
- білків, що репарують ДНК. У організмів із зовнішнім заплідненням (таких як амфібії) специфічний фермент фотоліаза[en], що репарує ДНК після впливу ультрафіолету;
- речовин, що захищають від хижаків. Їх поділяють на фізичні — оболонки яйцеклітини, такі як шкаралупа; та хімічні речовини, такі як піролізидиновий алкалоїд[en] у молі Utetheisa ornatrix[en];
- речовин, що захищають яйцеклітину від незвичних несприятливих умов. Так, у деяких видів жаб (Rheobatrachus) дозрівання яйця відбувається у шлунково-кишковому тракті. Для запобігання деградації клітини під дією травних ферментів та кислого pH, яйце виділяє інгібітори вивільнення кислот зі шлунку. Природа цих інгібіторів достеменно не відома, проте їх компонентом є простагландин E2[en].
У деяких видів розміщення цих факторів чітко визначено і вони займають певну частину ооплазми (див. розділ «Полярність яйцеклітини»)
Ядро яйцеклітини у більшості тварин диплоїдне, завершення мейозу відбувається після запліднення (див. розділ «Мейотичний поділ ооцита»), проте у деяких видів, таких як морські їжаки, мейоз завершується до запліднення і формується гаплоїдне ядро — пронуклеус, тоді як у більшості видів жіночий і чоловічий пронуклеуси формуються вже після запліднення.
Цитоплазму оточують декілька оболонок яйцеклітини.
Оболонки яйцеклітини
ред.Кортикальний шар
ред.Кортикальний шар не є окремою оболонкою, а є структурою всередині ооплазми яйцеклітини. Він складається з великої кількості кортикальних гранул, які прилягають до плазмалеми. Коли сперматозоїд потрапляє до яйцеклітини, вміст кортикальних гранул секретується у перивітеліновий простір, що розділяє яйцеклітину й вітелінову оболонку (блискучу оболонку у ссавців) та робить яйцеклітину непроникною для інших сперматозоїдів[6].
Під кортикальним шаром розташований білковий субкортикальний материнський комплекс.
Вітелінова оболонка
ред.Вітелінова оболонка[en], або первинна оболонка складається з білків, які допомагають сперматозоїду потрапити до яйцеклітини та виконують видоспецифічну бар'єрну функцію, забезпечуючи потрапляння сперматозоїду лише відповідного виду. Вітелінова оболонка притаманна безхребетним та хребетним, проте у ссавців вона специфічна й має назву zona pellucida. Як у ссавців, так і в інших організмів у білків вітелінової оболонки/zona pellucida наявний домен ZP, за допомогою якого відбувається полімеризація білків та ущільнення оболонки[8].
Вітелінова оболонка птахів
ред.Вітелінова оболонка птахів складається з двох шарів: внутрішнього та зовнішнього[8]. Внутрішній шар, перивітеліновий, завтовшки 1—3,5 мкм, сформований фібрилярними білками. Цей шар відповідає за видоспецифічне з'єднання сперматозоїдів і формується за тиждень до овуляції. У птахів після запліднення яйцеклітини в яйцеводі утворюється зовнішній шар, який блокує поліспермію[8]. Надалі під час руху яйцеводом навколо зиготи формується тверда оболонка — шкаралупа.
Вітелінова оболонка амфібій
ред.Найкраще вивчені яйцеклітини наступних безхвостих земноводних Xenopus laevis, Xenopus tropicalis, Discoglossus pictus та Bufo arenarum.
Після овуляції яйцеклітина безхвостих покрита целомічною оболонкою (англ. coelomic envelope). У цьому стані клітина не здатна до злиття зі сперматозоїдом, — така здатність набувається лише після перетворення целомічної оболонки у вітелінову. Вже в яйцеводі ооцит оточує желеподібний шар (англ. jelly coat) завтовшки 1 мм та вітелінова оболонка завтовшки 1 мкм. Вітелінова оболонка складається з фібрилярних білкових структур діаметром 12 та 19 нм, які з'єднані між собою й формують сітку. При заплідненні для запобігання поліспермії вітелінова оболонка стає непроникною, так званою оболонкою запліднення (англ. fertilization envelope)[8].
Яйцеклітини безхвостих мало вивчені. Відомо, що у безхвостих можлива поліспермія, через те що в них відсутні кортикальні гранули, які зазвичай ущільнюють вітелінову оболонку, тому в таких організмів не формується оболонки запліднення[8].
Zona pellucida
ред.Zona pellucida, блискуча оболонка, являє собою специфічну зовнішньоклітинну оболонку ооцита, притаманну ссавцям. Товщина блискучої оболонки може змінюватися від 1 до близько 25 мкм залежно від виду тварини. Zona pellucida складається з глікопротеїнів (ZP1—3 у миші; у людини, свині й деяких інших видів є додатковий ZP4[9]), які формують мережу мікрофібрил, щільно запакованих біля мембрани ооцита (оолеми) й більш розріджено — на периферії. Ооцити, що дозрівають, не одразу починають секретувати ZP-глікопротеїни. Коли ооцит переходить у своєму розвитку до диплотенової стадії першого поділу мейозу (яку іноді називають диктиотеною[en] див. мейотичний поділ ооцита) починається утворення zona pellucida[10]. Білки блискучої оболонки мишей формуються виключно ооцитом упродовж 3-4 тижнів[8].
Блискуча оболонка у мишей складається з трьох білків: ZP1 (623 амінокислотних залишки (акз) завдовжки, 68,7 кДа)[11], ZP2 (713 акз, 80,2 кДА)[12] та ZP3 (424 акз, 46,3 кДА)[13]. Ці білки глікозилюються як по аміногрупі аспарагіну, так і по гідроксильній групі серин-треоніну (N-[en] та O-зв'язане глікозування[en], відповідно)[10].
Через блискучу оболонку проходять так звані трансзональні проєкції від навколишніх гранульозних клітин, через які до ооцита надходять білки та інші речовини (див. малюнок «Структура преовуляційного фолікулу ссавців»)[7][8].
Променистий вінець
ред.Променистий вінець[en] технічно не є похідним яйцеклітини, а складається з окремих клітин, що мають назву купчастих[en] (лат. Cumulus oophorus). Вони оточують ооцит як у фолікулі, так і після овуляції. До овуляції купчасті клітини є найближчим до ооцита шаром гранульозних клітин[en], функція яких полягає в живленні ооцита через спеціальні утвори, трансзональні проєкції[7], які сполучають ці клітини.
Полярність яйцеклітини
ред.Яйцеклітина — це досить велика клітина організму й розміщення як поживних речовин, так і регуляторних елементів, мРНК та білків у ній може бути нерівномірним, більш того така полярність набувається за допомогою спеціальних механізмів і може виконувати специфічні функції.
У нематод Caenorhabditis elegans за одну годину після запліднення зигота набуває дуже поляризованого вигляду, починає нерівномірно ділитись, внаслідок чого дочірні клітини мають різний розмір та різну подальшу долю. Але незапліднена яйцеклітина ніякої полярності не виявляє. Місце потрапляння сперматозоїда є початковою точкою утворення полярності — у цьому місці зменшується концентрація актин-міозинового комплексу та білку цитоскелету NMY-2 (англ. nonmuscle myosin), формуючи задню частину передньо-задньої осі зародка. Проте нерівномірне розташування білків PAR[14] та атипової протеїнкінази C (aPKC, англ. atypical protein kinase C)[15] також важливі для формування полярності — у разі їх втрати дочірні клітини стають однакового розміру[16].
Нерівномірне розподілення речовин в цитоплазмі ооцита плодової мухи Drosophila melanogaster починається до запліднення й залежить від розміщення таких мРНК як bicoid та oskar[en] разом із дією PAR-білків. Тому, на відміну від круглих червів, нерівномірність цитоплазми зиготи у мух не залежить від точки потрапляння сперматозоїда в яйцеклітину[16].
У ссавців така визначеність подальшої долі клітин зародка відсутня — ще на стадії восьми бластомер мишиного зародку кожен із них може дати початок цілому організму[17].
Види яйцеклітин
ред.Яйцеклітини різних організмів мають неоднакову кількість жовтка. Ця різниця залежить від того, який спосіб розмноження притаманний цим тваринам. Так, у тварин, що відкладають яйця (птахи, рептилії, риби) жовтка багато — весь він піде на потреби зародка, і під час ембріогенезу поступово буде використаний новим організмом. Такі яйцеклітини є полілецитальними[18].
Мезолецитальні яйцеклітини амфібій мають середню кількість жовтка, який концентрується на одному полюсі, вегетативному. На протилежному полюсі, анімальному, міститься ядро яйцеклітини й більшість органел.
У ссавців формується плацента, яка годує зародок, тому потреби у великій кількості запасних речовин немає, і яйцеклітини містять мало жовтка. Такі ооцити мають назву оліголецитальних. До оліголецитальних яйцеклітин також належать яйцеклітини морського їжака, морської зірки, ланцетника[19].
Також яйцеклітини поділяють за розподіленням жовтка. У ссавців, равликів, морських їжаків жовток розподілений рівномірно — вони мають ізолецитальні яйцеклітини. У комах центролецитальні ооцити — жовток розташований посередині. Телолецитальні яйцеклітини притаманні рибам, птахам — в них лише невелика кількість клітини вільна від жовтка[6]. Залежно від типу яйцеклітини після запліднення дроблення перебігатиме по-різному.
Оогенез
ред.Яйцеклітина формується в результаті процесу, що має назву оогенез. На відміну від сперматогенеза (утворення сперматозоїдів), оогенез у більшості видів тварин призводить до утворення досить великої клітини, яка буде малорухливою, але містить велику кількість цитоплазми та запасних речовин[6]. Для зменшення кількості хромосом яйцеклітина у процесі оогенезу проходить усі стадії мейозу, проте визначною рисою мейотичного поділу ооцита є нерівномірність дочірніх клітин: одна з чотирьох утворених клітин містить більшість материнської цитоплазми — ця клітина й стає яйцеклітиною, тоді як решта дочірніх клітин (полярні тільця) цитоплазми майже не містять (див. мал. «Ооцит і полярне тільце миші»).
Оогенез найкраще вивчений у безхребетних, які мають ооцити великих розмірів (морські їжаки, морські зірки) та хребетних, яким притаманне зовнішнє запліднення (амфібії, риби). Оогенез ссавців вивчено погано, що пов'язано як із невеликою кількістю ооцитів, що утворюються за життя тварини, так і з технічними труднощами їх вивчення. Наприклад, оогенез у морського їжака легко стимулювати ін'єкцією 0,5 M KCl та надає можливість отримати мільйони яйцеклітин, які можна вивчати в розчині солоної води, тоді як з одного гризуна можна отримати приблизно 30 ооцитів, кожен з яких потребує складного поживного середовища та певних вузьких температурних умов[20].
Залежно від способу розмноження, оогенез у тварини перебігає по-різному. У тварин, які продукують велику кількість ооцитів (риби або амфібії, у вигляді ікри) стадії оогенезу можуть повторюватися впродовж життя. У тварин, які упродовж життя формують порівняно невелику кількість ооцитів (більшість ссавців, включаючи людину) оогенез відбувається лише один раз, без повторення стадій, і ті первинні ооцити, що заклалися в ембріональний період, упродовж життя поступово дозрівають і овулюють, а їх запаси не оновлюються.
Яйцеклітини починають утворюватися в ембріональний період. На початкових стадіях розвитку гамет майбутні ооцити не відрізняються від майбутніх сперматозоїдів. Такі клітини називаються примордіальними або первинними гоноцитами (англ. primordial germ cells, PCG).
Примордіальні клітини можуть утворюватися двома шляхами[21]:
- у деяких тварин примордіальні гоноцити формуються від нерівномірного розподілу факторів, які впливають на диференціацію клітин, ще в цитоплазмі ооцита. Такий шлях іноді називається преформізмом — доля клітин визначається ще у яйцеклітині.
- у інших тварин, включаючи ссавців, гоноцити формуються наново. Такий шлях утворення примордіальних гоноцитів називається індукцією — ці клітини повинні вирізнитися з інших ембріональних клітин вже в період після імплантації.
Примордіальні гоноцити мітотично діляться й мігрують під час гаструляції до місця, де буде утворено гонади[22]. Приблизно до середини ембріогенезу у мишей та до 6 тижня ембріогенезу в людини формуються біпотенційні гонади, які можуть розвинутися в чоловічі або жіночі статеві органи[23]. Статева диференціація гонад залежить від наявності або відсутності у ембріона гену SRY (англ. sex-determining region Y), який спричиняє розвиток гонад у сім'яники. Ген SRY закодований у Y-хромосомі, яку може принести сперматозоїд під час запліднення. Якщо ж сперматозоїд несе X-хромосому, то через відсутність гену SRY будуть утворені яєчники.
У людини оогенез продукує близько 7 мільйонів попередників ооцитів, оогоній, до 7 місяця ембріогенезу[6]. Але далі більшість із них гине запрограмованою клітинною загибеллю і лише невелика їх кількість, 6-7 %[1], починає мейотично ділитись. Такі клітини називаються первинними ооцитами. Первинні ооцити доходять до диплотенової стадії мейотичного поділу, приблизно середина кросинговеру, коли гомологічні хромосоми знаходяться близько один до одної та обмінюються генетичною інформацією. На цій стадії настає пауза. У ссавців уже після народження, під час так званого пубертатного періоду (статевого дозрівання) первинні ооцити продовжують мейотичний поділ, стають вторинними ооцитами, і починають вивільнюватися один за одним в процесі овуляції. Але завершення мейозу в мишей і в людини відбувається вже після запліднення[22].
Початок пубертатного періоду й подальші періоди овуляції, менструальний цикл, контролюються рівнем не лише статевих гормонів, таких як ФСГ, але й достатністю харчування, наприклад, через гормон ґрелін[24].
У дрозофіли під час оогенезу відокремлюється спеціалізована плазма зародка (англ. germ plasm), з якої вже після запліднення сформуються зачатки гонад, що увійдуть в мейоз після вилуплення зрілої особини[22].
Генетика оогенезу
ред.Одним із головних завдань формування як чоловічих, так і жіночих статевих клітин є досягнення гаплоїдного набору хромосом (n), який стає диплоїдним (2n) після запліднення, коли дві статеві клітини, кожна з яких має n хромосом, зливаються (див. плоїдність). Але поведінка статевих хромосом під час оогенезу відрізняється від сперматогенезу. Первинна яйцеклітина має каріотип XX. На відміну від сперматогенезу, де хромосоми X та Y відокремлені у так звані статеві або XY-тільця, під час оогенезу обидві X-хромосоми активні[25] і лише після запліднення, якщо сперматозоїд принесе другу X-хромосому, одна з них буде інактивована.
Хроматин ооцитів також має свої особливості. Обидва види гамет мають нестандартні варіанти гістонів, які формують нуклеосоми, на які накручується молекула ДНК. У той час як у сперматозоїдів є варіанти гістонів H2A (макроН2A (mH2A), H2A.X та фосфорильований γH2A.X) та H3 (H3.3), які можуть запакувати ДНК дуже щільно, яйцеклітина має лише один специфічний гістон H1oo[26]. Але цікавою особливістю H1-гістона є те, що він не формує нуклеосому, а є лінкерним (поєднувальним), тобто об'єднує нуклеосоми між собою, щоб створити щільнішу хромосомну структуру. Роль варіанту H1oo ще не до кінця з'ясована, але він є високо консервативним у тварин. Також ооцити мають H3.3 та mH2A впродовж мейозу[26].
Транскрипційна активність яйцеклітини
ред.Репресія транскрипції
ред.Під час оогенезу прекурсори гамет транскрипційно неактивні певний час, поки вони мігрують до гонад. У цей період гоноцити мають бути захищеними від впливу, який може призвести до їх диференціації у клітини зародкових листків. У цей час активну роль грає реорганізація хроматину, а у червів та мух також відбувається пригнічення активності РНК-полімерази[22] через фосфорилювання її C-кінцевого домену кіназою P-TEFb[en] (англ. positive transcription elongation factor b). Підтримка неактивної РНК-полімерази відбувається за допомогою білка Nanos[21].
Експресія генів
ред.У більшості тварин (за винятком комах) яйцеклітина все ж таки продукує певні мРНК. З її ДНК зчитуються гени, які необхідні для метаболізму клітини та для проведення специфічних для ооцоиту процесів. Також ооцит має накопичити в своїй цитоплазмі РНК, які будуть необхідні ембріону під час перших поділів бластуляції доти, поки не будуть активовані власні гени зиготи. Так, у миши під час оогенезу лише яйцеклітина зчитує мРНК глікопротеїнів блискучої оболонки ZP1, ZP2, та ZP3 (англ. zona pellucida glycoprotein 1-3)[6][27].
Мейотичний поділ ооцита
ред.Найголовнішою особливістю мейотичного поділу ооцита, на відміну від сперматозоїда, є велика асиметричність поділів та неоднакова доля дочірніх клітин. Мейоз яйцеклітини ссавців починається в ембріогенезі, коли організм самиці ще не народився. Але мейотичний поділ не відбувається одразу з початку до кінця — є два періоди спокою: довший і коротший. До народження мейоз проходить до стадії диплотени 1 поділу і в такому вигляді ооцит перебуває багато часу — від місяців до років, залежно від виду ссавців — до статевої зрілості. Тоді, після овуляції яйцеклітина завершує перший поділ мейозу й зупиняється на стадії G2 клітинного циклу[28].
Також особливість мейотичного поділу ооцитів першого порядку ссавців полягає в тому, що сумарним виходом мейозу можуть бути три клітини, а не чотири, як при діленні сперматоцитів[en] першого порядку. Після першого поділу перше дочірнє полярне тільце може потім не завершити поділ, внаслідок чого з одного первинного ооцита утворюється одна яйцеклітина, перше полярне тільце та друге полярне тільце[29].
У деяких видів саламандр та риб (Poecilia formosa) генетичний матеріал сперматозоїда не бере участі у заплідненні, хоча чоловіча гамета потрібна для стимуляції формування зиготи. Такий вид розмноження називається гіногенезом. Диплоїдність яйцеклітини досягається або мейотичним гіногенезом — при повторному залученні генетичного матеріалу другого полярного тільця, або мітотичним гіногенезом — нерозходженням матеріалу після першого ділення мітозом[30][31].
Галерея
ред.-
Ооцит людини на стадії метафази першого поділу мейозу. В позиції на 11 годину знаходиться веретено поділу.
-
Ооцит людини на стадії анафази першого поділу мейозу. В позиції на 8 годину знаходиться веретено поділу (мейоз І), воно розміщене в місці відділення першого полярного тільця ооциту. Вловлено момент початку відділення першого полярного тільця.
-
Ооцит людини на стадії телофази першого поділу мейозу. В позиції на 7 годину в перивітеліновому просторі знаходиться перше полярне тільце, але залишки веретена поділу ще зв’язують його з ооцитом, що вказує на фінальні етапи першого поділу мейозу.
-
Ооцит людини на стадії метафази другого поділу мейозу. Зрілий та готовий до запліднення ооцит людини. В позиції на 12 годину в перивітеліновому просторі знаходиться перше полярне тільце. Під полярним тільцем в самому ооциті чітко візуалізується веретено другого поділу мейозу на стадії метафази. Візуалізується тришарова блискуча оболонка ооциту.
Редукція центросоми
ред.Центросоми в гаметах спостерігали вже 100 років тому, однак поведінка їх у статевих клітинах зрозуміла набагато менше, ніж у соматичних. У деяких організмів спостерігається редукція центросом у гаметах[20].
Розходження хромосом під час метотичного поділу в нестатевих (соматичних) клітинах відбувається завдяки утворенню веретена поділу — скупчення мікротрубочок та спеціальних білків, які розміщені на полюсах клітини, що ділиться. В основі цієї структури лежить головний центр організації мікротрубочок (ЦОМТ, англ. major microtubule-organizing centre, MTOC) — центросома, що складається з центріолей та додаткових прицентріольних білків. Ще однією особливістю мейотичного поділу яйцеклітини є відсутність канонічної центросоми[2].
Організація веретена поділу мишачого ооцита відбувається завдяки скупченню декількох ацентріольних центрів організації мікротрубочок (англ. acentriolar microtubules-organizing centres, aMTOC). Такі аЦОМТ насичені білками γ-тубулін[32] та pericentrin[33][2].
Перехід від ацентросомного поділу до нормального метотичного поділу зі стандартною центросомою відбувається не одразу після запліднення й настає на стадії бластоцисти[2].
Стадії оогенезу
ред.| Назва стадії | Опис |
| Гоноцит або первинні статеві клітини (PGC, англ. primordial germ cells) | Не диференційовані на чоловічі чи жіночі попередники статевих клітин. Мігрують до первинних гонад (гонадного валику), у процесі чого діляться мітотично. Там диференціюються або на жіночі оогонії або на чоловічі сперматогонії.[34] |
| Оогоній | Клітини, які перебувають у гонадних валиках і діляться мітотично. Інтенсивність поділу в них збільшується, у порівнянні з гоноцитами під час імміграції[34] |
| Ооцит першого порядку (чи первинний ооцит)[35] | Клітина, яка увійшла в мейоз і пройшла в ньому до диплотени першого поділу (ссавці та мухи) або до діакінезу першого поділу (C. elegans)[22]. Зазвичай саме в цій стадії перебувають статеві клітини в гонадах ссавців більшість часу — мейоз починається ще до народження, а вихід із паузи відбувається одразу перед овуляцією. У людини ооцит першого порядку переходить до наступної фази під дією ФСГ, завершує перший поділ мейозу та формує дві дочірні клітини: ооцит другого порядку і полярне тільце з невеликою кількістю цитоплазми[35]. |
| Ооцит другого порядку (чи вторинний ооцит)[35] | Клітина, яка вийшла з паузи першого поділу мейозу, у зв'язку з овуляцією (ссавці) або під дією чоловічих статевих гормонів MSP (англ. major sperm protein) у нематод (фактори, що впливають на продовження мейозу в мух, не з'ясовані). Мейоз продовжується до наступної паузи: метафаза 2 поділу (ссавці), метафаза 1 поділу (мухи) чи анафаза 1 поділу (нематоди)[22]. Ооцит другого порядку під час переходу до наступної фази завершує мейотичний поділ і ділиться на дві клітини: зрілу яйцеклітину й полярне тільце[35]. |
| Зрілий ооцит або яйцеклітина | Клітина, яка завершує мейоз. У ссавців і нематод відбувається під час запліднення сперматозоїдом, тоді як у мух усі ці стадії завершуються до овуляції, а вихід з паузи під час метафази 1 поділу відбувається завдяки впливу тиску й вологості[22]. З одного первинного ооцита формується одна яйцеклітина, до якої переходить майже вся ооплазма, і полярні тільця (два чи три, залежно від того, чи завершить поділ перше полярне тільце[29])[35]. |
Запліднення
ред.Високодиференційовані статеві клітини, які налаштовані під одну функцію, а саме запліднення, повинні при злитті створити зиготу — тотипотентну клітину, яка дасть основу всім видам клітин зародка і з якої сформується цілий організм. Тому під час запліднення з яйцеклітиною, яка являє собою більшу частину об'єму майбутньої зиготи, відбувається серія змін.
Характерною властивістю яйцеклітини є блокування проникності оболонок після контакту з акросомою першого сперматозоїда та її активація — перехід зі стану спокою до розвитку. Яйцеклітини певних видів організмів можуть бути також самодостатніми ланками статевого розмноження (не потребують сперматозоїдів для активації) — таке розмноження називається партеногенезом.
Акросомна реакція
ред.Для запліднення сперматозоїд мусить пройти шар гранульозних клітин та блискучу оболонку яйцеклітини. Для цього на апікальній частині сперматозоїда формується особлива везикула — акросома, яка містить речовини, здатні розщепити zona pellucida та дозволити потрапляння сперматозоїда всередину яйцеклітини. Акросомна реакція починається під час контакту акросоми з ZP3-білками блискучої оболонки й вміст акросоми вивільнюється у Ca2+-залежному екзоцитозі[36][37]
Використання яйцеклітин у клініці та лабораторних дослідженнях
ред.Індукція плюрипотентності
ред.Під час онтогенезу клітини-попередники діляться й диференціюються у спеціалізовані клітини. Здатність однієї клітини-попередника дати зачаток клітинам різних зародкових шарів і потім перетворитися на спеціалізовану клітину називається потентністю[en]. Запліднена яйцеклітина, зигота, — це тотипотентна клітина, яка дає зачаток усім клітинам організму. Під час ембріогенезу певні клітини діляться й диференціюються на плюрипотентні стовбурові клітини — такі, що при ділені дають зачаток багатьом різним клітинам, але в межах різних зародкових шарів (наприклад, мезодерми). Під час подальшої диференціації клітини стають уніпотентними — здатними до ділення попередниками лише одного виду клітин. Більшість соматичних клітин дорослого організму перебувають в диференційованій стадії й пристосовані для виконання спеціальних функцій.
Соматичні клітини в лабораторних умовах можуть бути перепрограмовані у плюрипотентні стовбурові клітини. Ця процедура має дуже широке використання in vitro — від моделювання хвороб до тестування ліків[38].
Одним з видів індукції плюрипотентності є пересадки ядер соматичних клітин. При такій процедурі ядро яйцеклітини видаляється, а на заміну підсаджується ядро соматичної клітини[39]. Таким чином була клонована вівця Доллі[40].
Мітохондріальна ДНК
ред.ДНК в клітині організму міститься не лише в ядрі. Мітохондрії — спеціалізовані органели, які продукують молекули АТФ — мають свою власну ДНК (мтДНК). Під час запліднення в більшості організмів (проте не в усіх) ембріон отримує мітохондрії лише від яйцеклітини і, відповідно, мітохондріальну ДНК лише від матері. Винятками є деякі види молюсків. Цей результат забезпечується за допомогою двох процесів: автофагії мітохондрій, які запліднена яйцеклітина отримала від сперматозоїда, та деградації батьківської мтДНК під час сперматогенезу[41].
Тому мітохондріальна ДНК організму успадковується від матері (лише самиці передають мтДНК до наступного покоління). Цей факт застосовується в генетичних аналізах для побудови генеалогічних дерев, встановлення еволюційного походження видів, тощо.
Яйцеклітина рослин
ред.Рослини здатні до розмноження вегетативним (нестатевим) та генеративним шляхом, або статевим — зі зливанням чоловічої та жіночої гамет. При розмноженні статевим шляхом необхідний перехід рослини з вегетативного стану до генеративного.
Покритонасінні
ред.Утворення квітки розпочинається процесом евокації — фізіологічної, біохімічної та генетичної перебудови верхньої частини стебла (апексу) і відбувається флоральна детермінація[42].
У маточці квітки у насінному зачатку міститься нуцелус, вкритий спеціальними покривами — інтегументами. У нуцелусі знаходитися археспоріальна клітина[en] з диплоїдним набором хромосом, 2n. Археспоріальна клітина ділиться мейотично, утворюючи чотири макроспори[en] з гаплоїдним набором хромосом, 1n. З цих чотирьох клітин три руйнуються і лише одна макроспора залишається, ділиться вже мітотичним шляхом тричі й утворює зародковий мішок (жіночий гаметофіт), який складається з семи клітин, які містять загалом вісім ядер, оскільки одна з клітин має два ядра. Кожне ядро містить гаплоїдний набір хромосом, 1n[42][43].
Під час утворення зародкового мішка після першого мітотичного поділу макроспори, дві дочірні клітини розходяться до різних полюсів гаметофіту. Таким чином гаметофіт набуває своєї полярності — різниці в структурі від одного краю до іншого (див. малюнок «Зародковий мішок квіткових рослин»). На полюсі, де знаходиться мікропіле («A» на малюнку) містить яйцеклітину, (на малюнку жовта, позначена «C») та дві допоміжні клітини синергіди («D» на малюнку). Інший полюс формує базальну частину зачатку, халазу («B» на малюнку). Там три гаплоїдних ядра формують три клітини-антиподи («F» на малюнку). У зародковому мішку по центру міститься клітина вторинно диплоїдна — ендосперм («E»)[42].
Синергіди виконують важливу роль при заплідненні. Їхня клітинна стінка формує велику кількість вп'ячувань всередину цитоплазми клітини, збільшуючи площу поверхні плазматичної мембрани, нитковидною структурою (англ. filiform apparatus)[44]. Разом з розвиненим ендоплазматичним ретикулом[44] це дозволяє синергідам виділяти хемотропні речовини[42] для проростання пилкових зерен до яйцеклітини та ендосперму, де один зі сперміїв запліднює яйцеклітину, інший, з диплоїдним ядром центральної клітини, формує ендосперм. Це явище було відкрито у Києві у 1898 році Сергієм Навашиним і отримало назву подвійного запліднення[42]. Під час проростання пилкових зерен клітини-синергіди руйнуються[44].
Яйцеклітина покритонасінних рослин поляризована. Вакуоля порівняно великих розмірів розміщується ближче до мікропіле, у той час, як ядро клітини розташовано ближче до основи[42].
Яйцеклітини інших організмів
ред.Багато організмів мають змогу розмножуватися як статево, так і безстатево (вищі рослини, водорості). Причому під час статевого розмноження гамети можуть відрізнятися або не відрізнятися за розміром, морфологією й рухливістю. Залежно від цього відрізняють:
- ізогамію — гамети однакові за розміром і рухливістю.
- гетерогамію — гамети відрізняються за розміром і рухливістю. Це називають ще анізогамією.
- відрізняють окремий вид гетерогамії — оогамію, коли яйцеклітина велика й нерухома, а чоловіча статева клітина маленька й рухлива (притаманна ссавцям та іншим хребетним).
Говорити про яйцеклітину має сенс лише у випадку гетерогамії.
Водорості
ред.Водорості — це дуже різнорідна нетаксономічна група організмів, яким притаманне як нестатеве, так і статеве розмноження різних типів.
Зелені водорості
ред.Можуть розмножуватися ізогамно чи анізогамно.
Особини роду Eudorina[en] мають яйцеклітини з двома джгутиками. Колонії Volvox мають спеціалізовані клітини, здатні продукувати гамети — яйцеклітини та чоловічі гамети. При цьому більшість інших клітин колонії здатна лише до вегетативного розмноження. Після злиття гамет формується зигоспора. Представники роду Oedogonium[en] здатні до статевого розмноження й продукують оогонії з одною великою яйцеклітиною без джгутиків, яку запліднює чоловіча гамета з великою кількістю джгутиків. Організми роду Oedogonium мають як представників, що можуть продукувати чоловічі й жіночі статеві клітини в одному гаметофіті, так і представників, які продукують лише один вид гамет[45].
Червоні водорості
ред.Червоним водоростям притаманне безстатеве або статеве розмноження оогамією. Гаметофіти продукують жіночі та чоловічі гаметангії. Жіночий гаметангій має назву карпогоній, він формується на спеціальному вирості (англ. carpogonial branche)[46]. Яйцеклітина велика та не має джгутиків. Чоловічі статеві клітини сперматії також не мають джгутиків, тому запліднення відбувається завдяки перенесенню чоловічих гамет течією води[45].
Бурі водорості
ред.Мають як ізогамні, так і гетерогамні гамети. При оогамії яйцеклітини не мають джгутика, а чоловічі гамети — мають[45].
Гриби
ред.Гриби, як і водорості, є великою різноманітною групою організмів, яким притаманне як статеве, так і безстатеве розмноження[47].
Ооміцети
ред.Ооміцетам притаманне статеве розмноження з гетерогаметними статевими клітинами. Яйцеклітина має назву оосфера — її продукує оогоній. Чоловіча статева клітина не активно рухлива — вона формується в антеридії та потрапляє до оосфери завдяки процесу, що має назву копуляція гаметангіїв — гаметангії різних статей тісно контактують один з одним і ядро з антеридію потрапляє до оосфери. Каріотип гамет гаплоїдний, 1n, який формується внаслідок мейозу. Після запліднення формується зигота — ооспора[47].
Див. також
ред.Примітки
ред.- ↑ а б Kenneth, S. Saladin (2004). Anatomy and Physiology: The Unity of Form and Function. McGraw-Hill. с. 1161—1068. ISBN 0072919264.
- ↑ а б в г д Dean Clift & Melina Schuh (September 2013). Restarting life: fertilization and the transition from meiosis to mitosis. Nature reviews. Molecular cell biology. 14 (9): 549—562. doi:10.1038/nrm3643. PMID 23942453.
- ↑ Lopata Alex (2009). History of the Egg in Embryology. Journal of Mammalian Ova Research. 26 (1): 2—9. doi:10.1274/jmor.26.2. ISSN 1341-7738.
- ↑ Jeanine Griffin, Benjamin R. Emery, Ivan Huang, C. Matthew Peterson & Douglas T. Carrell (2006). Comparative analysis of follicle morphology and oocyte diameter in four mammalian species (mouse, hamster, pig, and human). Journal of experimental & clinical assisted reproduction. 3: 2. doi:10.1186/1743-1050-3-2. PMID 16509981.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ A. Gonzalez, D. G. Satterlee, F. Moharer & G. G. Cadd (September 1999). Factors affecting ostrich egg hatchability. Poultry science. 78 (9): 1257—1262. PMID 10515354.
- ↑ а б в г д е ж Scott F. Gilbert (2013). 4. Developmental Biology (English) (вид. 10). Sinauer Associates. ISBN 160535192X. Архів оригіналу за 10 липня 2015.
{{cite book}}: Cite має пустий невідомий параметр:|subscription=(довідка) - ↑ а б в Rong Li & David F. Albertini (March 2013). The road to maturation: somatic cell interaction and self-organization of the mammalian oocyte. Nature reviews. Molecular cell biology. 14 (3): 141—152. doi:10.1038/nrm3531. PMID 23429793.
- ↑ а б в г д е ж Magnus Monne, Ling Han & Luca Jovine (September 2006). Tracking down the ZP domain: From the mammalian zona pellucida to the molluscan vitelline envelope. Seminars in reproductive medicine. 24 (4): 204—216. doi:10.1055/s-2006-948550. PMID 16944418.
- ↑ Білок ZP4 людини в базі даних UniProt Q12836
- ↑ а б Paul M. Wassarman & Eveline S. Litscher (2013). Biogenesis of the mouse egg's extracellular coat, the zona pellucida. Current topics in developmental biology. 102: 243—266. doi:10.1016/B978-0-12-416024-8.00009-X. PMID 23287036.
- ↑ Білок ZP1 миші в базі даних UniProt Q62005
- ↑ Білок ZP2 миші в базі даних UniProt P20239
- ↑ Білок ZP3 миші в базі даних UniProt P10761
- ↑ Білок PAR-1 Caenorhabditis elegans в датабазі UniProt Q9TW45
- ↑ Білок aPKC Caenorhabditis elegans в датабазі UniProt Q19266
- ↑ а б Daniel St Johnston & Julie Ahringer (May 2010). Cell polarity in eggs and epithelia: parallels and diversity. Cell. 141 (5): 757—774. doi:10.1016/j.cell.2010.05.011. PMID 20510924.
- ↑ Adam Burton & Maria-Elena Torres-Padilla (November 2014). Chromatin dynamics in the regulation of cell fate allocation during early embryogenesis. Nature reviews. Molecular cell biology. 15 (11): 723—734. doi:10.1038/nrm3885. PMID 25303116.
- ↑ Zdzislaw Swiderski, Jordi Miquel, Jordi Torres & Eulalia Delgado (July 2013). Early intrauterine embryonic development of the bothriocephalidean cestode Clestobothrium crassiceps (Rudolphi, 1819), a parasite of the teleost Merluccius merluccius (L., 1758) (Gadiformes: Merlucciidae). Comptes rendus biologies. 336 (7): 321—330. doi:10.1016/j.crvi.2013.06.002. PMID 23932252.
- ↑ Zdzislaw Swiderski, Jordi Miquel, Isabel Montoliu, Carlos Feliu & David I. Gibson (September 2013). Ultrastructure of the intrauterine eggs of the microphallid trematode Maritrema feliui: evidence of early embryonic development. Parasitology research. 112 (9): 3325—3333. doi:10.1007/s00436-013-3512-2. PMID 23839172.
- ↑ а б Gaurishankar Manandhar, Heide Schatten & Peter Sutovsky (January 2005). Centrosome reduction during gametogenesis and its significance. Biology of reproduction. 72 (1): 2—13. doi:10.1095/biolreprod.104.031245. PMID 15385423.
- ↑ а б Susan Strome & Dustin Updike (July 2015). Specifying and protecting germ cell fate. Nature reviews. Molecular cell biology. 16 (7): 406—416. doi:10.1038/nrm4009. PMID 26122616.
- ↑ а б в г д е ж Bluma J. Lesch & David C. Page (November 2012). Genetics of germ cell development. Nature reviews. Genetics. 13 (11): 781—794. doi:10.1038/nrg3294. PMID 23044825.
- ↑ Martin M. Matzuk & Dolores J. Lamb (November 2008). The biology of infertility: research advances and clinical challenges. Nature medicine. 14 (11): 1197—1213. doi:10.1038/nm.f.1895. PMID 18989307.
- ↑ Весна-красна і молодість, зокрема період статевого дозрівання. Моя наука (Українська) . травень 2012. Архів оригіналу за 23 жовтня 2013. Процитовано 2015. [Архівовано 23 жовтня 2013 у Wayback Machine.]
- ↑ Michelle Alton, Mau Pan Lau, Michele Villemure & Teruko Taketo (February 2008). The behavior of the X- and Y-chromosomes in the oocyte during meiotic prophase in the B6.Y(TIR)sex-reversed mouse ovary. Reproduction (Cambridge, England). 135 (2): 241—252. doi:10.1530/REP-07-0383. PMID 18239052.
- ↑ а б Ian Maze, Kyung-Min Noh, Alexey A. Soshnev & C. David Allis (April 2014). Every amino acid matters: essential contributions of histone variants to mammalian development and disease. Nature reviews. Genetics. 15 (4): 259—271. doi:10.1038/nrg3673. PMID 24614311.
- ↑ Paul M. Wassarman & Eveline S. Litscher (2013). Biogenesis of the mouse egg's extracellular coat, the zona pellucida. Current topics in developmental biology. 102: 243—266. doi:10.1016/B978-0-12-416024-8.00009-X. PMID 23287036.
- ↑ E. Vogt, M. Kirsch-Volders, J. Parry & U. Eichenlaub-Ritter (March 2008). Spindle formation, chromosome segregation and the spindle checkpoint in mammalian oocytes and susceptibility to meiotic error. Mutation research. 651 (1-2): 14—29. doi:10.1016/j.mrgentox.2007.10.015. PMID 18096427.
- ↑ а б X. Johne Liu (October 2012). Polar body emission. Cytoskeleton. 69 (10): 670—685. doi:10.1002/cm.21041. PMID 22730245.
- ↑ S. M. Rogers & S. M. Vamosi (December 2010). Frozen F1's amidst a masterpiece of nature: new insights into the rare hybrid origin of gynogenesis in the Amazon molly (Poecilia formosa). Molecular ecology. 19 (23): 5086—5089. doi:10.1111/j.1365-294X.2010.04890.x. PMID 21091661.
- ↑ Irene E. Samonte-Padilla, Christophe Eizaguirre, Jorn P. Scharsack, Tobias L. Lenz & Manfred Milinski (2011). Induction of diploid gynogenesis in an evolutionary model organism, the three-spined stickleback (Gasterosteus aculeatus). BMC developmental biology. 11: 55. doi:10.1186/1471-213X-11-55. PMID 21910888.
{{cite journal}}: Обслуговування CS1: Сторінки із непозначеним DOI з безкоштовним доступом (посилання) - ↑ Білок γ-тубулін людини в датабазі UniProt P23258
- ↑ Білок pericentrin людини в датабазі UniProt O95613
- ↑ а б De Felici, Massimo (2013). Origin, Migration, and Proliferation of Human Primordial Germ Cells: 19—37. doi:10.1007/978-0-85729-826-3_2.
- ↑ а б в г д Томас В. Садлер (2001). Медична ембріологія за Ланґманом (Українська) . (переклад: Олександр Луцик, Оксана Кулик) (вид. 8,). Львів: Наутілус. с. 3-34. ISBN 966-95745-3-6.
- ↑ Stephen Publicover, Claire V. Harper & Christopher Barratt (March 2007). [Ca2+]i signalling in sperm--making the most of what you've got. Nature cell biology. 9 (3): 235—242. doi:10.1038/ncb0307-235. PMID 17330112.
- ↑ P. M. Wassarman, L. Jovine & E. S. Litscher (February 2001). A profile of fertilization in mammals. Nature cell biology. 3 (2): E59—E64. doi:10.1038/35055178. PMID 11175768.
- ↑ Marica Grskovic, Ashkan Javaherian, Berta Strulovici & George Q. Daley (December 2011). Induced pluripotent stem cells--opportunities for disease modelling and drug discovery. Nature reviews. Drug discovery. 10 (12): 915—929. doi:10.1038/nrd3577. PMID 22076509.
- ↑ K. Liu, Y. Song, H. Yu & T. Zhao (2014). Understanding the roadmaps to induced pluripotency. Cell death & disease. 5: e1232. doi:10.1038/cddis.2014.205. PMID 24832604.
- ↑ K. H. Campbell, J. McWhir, W. A. Ritchie & I. Wilmut (March 1996). Sheep cloned by nuclear transfer from a cultured cell line. Nature. 380 (6569): 64—66. doi:10.1038/380064a0. PMID 8598906.
- ↑ Bruce Alberts, Alexander Johnson, Julian Lewis, David Morgan, Martin Raff, Keith Roberts, Peter Walter (1 грудня 2014). Molecular Biology of the Cell (англ.) (вид. 6). Garland Science. с. 807. ISBN 0815345240.
- ↑ а б в г д е Мусієнко М. М. (2005). Фізіологія рослин (підручник) (укр) (вид. 2). Київ: Либідь. с. 601—610. ISBN 966-06-0373-8.
- ↑ Norman P. A. Huner William G. Hopkins (10 грудня 2009). Introduction to Plant Physiology (англ.) (вид. 4). Wiley, John & Sons. с. 275. ISBN 978-0-470-24766-2.
- ↑ а б в Eckardt N. A. (2007). Elucidating the Function of Synergid Cells: A Regulatory Role for MYB98. THE PLANT CELL ONLINE. 19 (8): 2320—2321. doi:10.1105/tpc.107.055640. ISSN 1040-4651.
- ↑ а б в punam kumar. Introduction to botany, CHAPTER 15: Algae structure and reproduction. Professional Education, Testing and Certification Organization International. Процитовано 11 вересня 2015.
- ↑ Kathleen M. Cole, Robert G. Sheath (1990). Biology of the Red Algae. Cambridge University Press. ISBN 0521343011.
- ↑ а б punam kumar. Introduction to botany, CHAPTER 14: Fungi structure and reproduction. Professional Education, Testing and Certification Organization International. Процитовано 11 вересня 2015.
Посилання
ред.- Oogenesis [Animation] (відео). Biology / Medicine Animations HD. 16 квітня 2014. Процитовано 10 липня 2015.
- Ovulation (відео). Nucleus Medical Media. 23 грудня 2009. Процитовано 27 липня 2015.
- Fertilization (відео). Nucleus Medical Media. 31 січня 2013. Процитовано 27 липня 2015.
Джерела
ред.- Томас В. Садлер (2001). Медична ембріологія за Ланґманом (Українська) . (переклад: Олександр Луцик, Оксана Кулик) (вид. 8,). Львів: Наутілус. с. 3-34. ISBN 966-95745-3-6. Процитовано 2015.
- Вільям Френсіс Ґанонґ (2002). Фізіологія людини (Українська) . (Наук.ред.перекладу: М.Гжегоцький, В.Шевчук, О.Заячківська). Львів: БаК. с. 397-412. ISBN 966-7065-38-3.
- Giovanni Coticchio, David F. Albertini, Lucia De Santis (2012). Oogenesis (англ.) (вид. XII). Springer. doi:10.1007/978-0-85729-826-3. ISBN 978-0-85729-825-6.
- Kenneth, S. Saladin (2004). Anatomy and Physiology: The Unity of Form and Function. McGraw-Hill. с. 1161—1068. ISBN 0072919264.
- Scott F. Gilbert (2013). Developmental Biology (English) (вид. 10). Sinauer Associates. с. 125. ISBN 978-1-60535-192-6.
{{cite book}}: Cite має пустий невідомий параметр:|subscription=(довідка) - Bruce Alberts, Alexander Johnson, Julian Lewis, David Morgan, Martin Raff, Keith Roberts, Peter Walter (1 грудня 2014). Molecular Biology of the Cell (англ.) (вид. 6). Garland Science. ISBN 0815345240.
- Мусієнко М. М. (2005). Фізіологія рослин (підручник) (укр) (вид. 2). Київ: Либідь. с. 601—610. ISBN 966-06-0373-8.
| Ця сторінка належить до добрих статей української Вікіпедії. |