Дронедарон
| Зауважте, Вікіпедія не дає медичних порад! Якщо у вас виникли проблеми зі здоров'ям — зверніться до лікаря. |
Дронедарон — синтетичний антиаритмічний препарат ІІІ класу для перорального застосування. Дронедарон розроблений компанією «Sanofi-Aventis»[1], та випускається нею під торговою назвою «Мультак».
 | |
|---|---|
Дронедарон
| |
| Систематизована назва за IUPAC | |
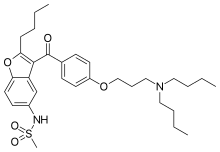
| N-(2-Butyl-3-(p-(3-(dibutylamino)propoxy)benzoyl)- 5-benzofuranyl)methanesulfonamide | |
| Класифікація | |
| ATC-код | C01 |
| PubChem | |
| CAS | |
| DrugBank | |
| Хімічна структура | |
| Формула | C31H44N2O5S |
| Мол. маса | 556,758 г/моль |
| Фармакокінетика | |
| Біодоступність | 15% |
| Метаболізм | Печінка |
| Період напіввиведення | 25—30 год. |
| Екскреція | фекалії,Нирки |
| Реєстрація лікарського засобу в Україні | |
| Назва, фірма-виробник, країна, номер реєстрації, дата | МУЛЬТАК®, «Санофі Вінтроп Індастріа»,Франція UA/10412/01/01 15.02.2010-15/02/2015 |
Фармакологічні властивості
ред.Дронедарон — синтетичний антиаритмічний препарат ІІІ класу, що є похідним бензофурану. По своїй хімічній структурі має подібність із аміодароном.[1][2] У молекулі дронедарону відсутні атоми йоду, тому препарат не має токсичного впливу на щитоподібну залозу та є менш ліпофільним, що також частково зменшує побічні ефекти, пов'язані з іншими органами та системами.[1] Антиаритмічна дія дронедарону пов'язана з блокуванням іонних каналів, переважно калієвих, у меншій мірі — натрієвих та кальцієвих, а також має неконкурентну антиадренергічну дію. Це дає підстави вважати, що препарат має властивості, що характеризують усі чотири класи антиаритмічних препаратів. Дронедарон сповільнює частоту серцевих скорочень; подовжує інтервали AH, PQ, QT та незначно подовжує інтервали QTc, HV та QRS; збільшує ефективні рефрактерні періоди в передсерді, атріовентрикулярному вузлі та шлуночку; знижує артеріальний тиск та скоротливу здатність міокарда, не знижуючи фракцію викиду лівого шлуночка та знижує споживання міокардом кисню. Препарат має властивості вазоділятатора, може зменшувати опір коронарних судин. При перших мультицетрових дослідженнях дронедарону в порівнянні із аміодароном було зазначено, що дронедарон менш ефективний у профілактиці рецидивів фібриляції передсердь, але при його застосуванні спостерігається менше побічних ефектів.[2][3] При подальших дослідженнях було встановлено, що при тривалій терапії дронедароном виникає більший ризик смерті від серцево-судинних причин, а також більший ризик виникнення інсульту, судинної емболії, інфаркту міокарду, та спостерігалось збільшення частоти госпіталізації хворих.[4] Ці дані, а також часті випадки уражень печінки включно із печінковою недостатністю, дало підстави FDA рекомедувати обмежити використання препарату та достроково припинити клінічні дослідження із препаратом.[5][6]
Фармакодинаміка
ред.Дронедарон при пероральному прийомі повільно всмоктується, максимальна концентрація в крові досягається протягом 3—6 годин. Абсолютна біодоступіність препарату складає лише 15% через ефект першого проходження через печінку, при прийомі дронедарону з їжею біодоступність препарату підвищується. Дронедарон добре зв'язується із білками плазми крові. Метаболізується препарат в печінці з утворенням активних метаболітів. Точних даних за проникнення через плацентарний бар'єр та виділення в грудне молоко препарату немає, але експерименти на тваринах виявили тератогенний ефект у дронедарону. Виводиться дронедарон із організму переважно із калом, частково із сечею у вигляді метаболітів. Період напіввиведення препарату складає 25—30 годин, при печінковій недостатності цей час може збільшуватися.
Показання до застосування
ред.Дронедарон застосовується при непостійній формі фібриляції передсердь із стабільним станом (І—ІІ клас по NYHA) для попередження рецидиву аритмії або зменшення частоти серцевих скорочень.
При застосуванні дронедарону можливі наступні побічні ефекти:
- Алергічні реакції — часто (1—10%) висипання на шкірі, свербіж шкіри; нечасто (0,1—1%) алергічний дерматит, фотодерматоз, екзема, еритема шкіри.
- З боку травної системи — часто (1—10%) нудота, блювання, діарея, біль у животі, диспепсія; у рідкісних випадках — порушення функції печінки з імовірним розвитком печінкової недостатності.[6]
- З боку нервової системи — часто (1—10%) астенія, швидка втомлюваність, дисгевзія; рідко (0,01—0,1%) агевзія.
- З боку серцево-судинної системи — дуже часто (більше 10%) подовження інтервалу QT; часто (1—10%) брадикардія.
- Зміни в лабораторних аналізах — дуже часто (більше 10%) підвищення рівня сечовини та креатиніну в крові.
Протипокази
ред.Дронедарон протипоказаний при підвищеній чутливості до препарату, при брадикардії, синдромі слабості синусового вузла (при відсутності кардіостимулятора), високій атріовентрикулярній блокаді, пацієнтам із нестабільною гемодинамікою (клас ІІІ—IV по NYHA), при вагітності та годуванні грудьми, подовженні інтервалу QT, важкій печінковій та нирковій недостатності. Немає даних про застосування дронедарону у дітей та підлітків. Дронедарон не застосовується сумісно із кетоконазолом, ітраконазолом, вориконазолом, телітроміцином, кларитроміцином, еритроміцином, нефазодоном, циклоспорином, ритонавіром, похідними фенотіазину, цизапридом, бепридилом, трициклічними антидепресантами, терфенадином, антиаритмічними препаратами I та III класу, а також із препаратами звіробою та грейпфрутовим соком.
Форми випуску
ред.Дронедарон випускається у вигляді таблеток по 0,4 г.
Примітки
ред.- ↑ а б в Архівована копія. Архів оригіналу за 8 серпня 2014. Процитовано 2 серпня 2014.
{{cite web}}: Обслуговування CS1: Сторінки з текстом «archived copy» як значення параметру title (посилання) - ↑ а б Архівована копія. Архів оригіналу за 8 серпня 2014. Процитовано 2 серпня 2014.
{{cite web}}: Обслуговування CS1: Сторінки з текстом «archived copy» як значення параметру title (посилання) - ↑ http://www.medmir.com/content/view/1795/61 [Архівовано 12 серпня 2014 у Wayback Machine.] (рос.)
- ↑ http://www.webcardio.org/dronedaron-dosrochno-prekrashheno-issledovanie-pallas.aspx [Архівовано 8 серпня 2014 у Wayback Machine.] (рос.)
- ↑ Køber L, Torp-Pedersen C, McMurray JJ та ін. (June 2008). Increased mortality after dronedarone therapy for severe heart failure. N Engl J Med. 358 (25): 2678—87. doi:10.1056/NEJMoa0800456. PMID 18565860.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) (англ.) - ↑ а б http://www.fda.gov/Drugs/DrugSafety/ucm240011.htm [Архівовано 16 вересня 2014 у Wayback Machine.] (англ.)
Джерела
ред.- Дронедарон на сайті mozdocs.kiev.ua [Архівовано 23 березня 2016 у Wayback Machine.]
- http://www.rlsnet.ru/tn_index_id_46918.htm [Архівовано 3 липня 2014 у Wayback Machine.]
- http://cardiolog.org/lekarstva/80-antiaritmicheskie-sredstva-3/259-dronedaron.html [Архівовано 9 серпня 2014 у Wayback Machine.]