Патофізіологія гіпертензії
| Ця стаття потребує уваги й турботи фахівця у своїй галузі. |
«Патофізіологія гіпертензії» — це область активних досліджень, які націлені на виявлення причин гіпертензії. Гіпертензія є хронічним захворюванням, яка характеризується підвищенням кров'яного тиску. Гіпертензія може класифікуватись як есенціальна або як вторинна. Есенціальною гіпертензія зветься, коли жодної специфічної причини не може бути знайдено для пояснення стану пацієнта. Біля 90-95% випадків гіпертензії є есенціальною гіпертензією. [1][2][3][4] Вторинною — гіпертензія зветься тоді, коли високий кров'яний тиск є результатом іншого прихованого процесу, такого як захворювання нирок чи пухлини (адреналової аденоми чи феохромоцитоми). Стійка гіпертензія є одним з факторів ризику інсульту, серцевого нападу, серцевої недостатності та артеріальної аневризми, і є провідною причиною хронічної ниркової недостатності.[5]
Більшість механізмів, що ведуть до вторинної гіпертензії вже добре вивчені. Патофізіологія есенціальної гіпертензії залишається зоною активного дослідження, з багатьма теоріями та різним зв'язком з багатьма факторами ризику.
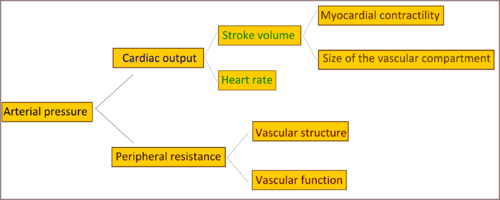
Серцевий викид та периферійний опір є двома детермінантами артеріального тиску.[6] Серцевий викид визначається систолічним об'ємом крові та частотою серцевих скорочень. Систоличний об'єм крові пов'язаний з скоротливістю міокарду та розміром судинного русла. Периферичний опір визначається функціональними та анатомічними змінами в малих артеріях та артеріолах.
Генетика ред.
Докази генетичного впливу на кров'яний тиск походять з різних джерел.[7] Існує більша подібність в кров'яному тиску всередині сімей, ніж поміж сім'ями, що демонструє існування певної міри успадкування.[8] And it was proved that this finding wasn't due to shared environmental factors.[9] Доведено, що одиничні мутації генів викликають менделівські форми успадкування високого та низького кров'яного тиску.[10] Було ідентифіковано майже 10 генів, що викликають такі форми гіпертензії.[10][11] Такі мутації впливають на кров'яний тиск шляхом порушення утримання солі нирками.[12] Нещодавно і завдяки новим методам генетичного аналізу дослідники знайшли статистично значимий зв'язок кров'яного тиску з кількома ділянками хромосом, включаючи регіони, що пов'язані з комбінованою гіперліпідемією.[13][14][15][16][17] Ці знахідки припускають, що існує багато генетичних локусів, кожен з яких створює невеликий вплив на кров'яний тиск в загальній популяції. В цілому, все ж таки, ідентифіковані моногенні фактори не є типовими для гіпертензії, що свідчить про мультифакторну природу есенціальної гіпертензії.[2][7][18][19]
Найбільш вивчений моногенний фактор розвитку гіпертензії є синдром Ліддла, рідкісний але клінічно важливий розлад, при якому конститутивна активація епітеліальних натрієвих каналів призводить до тяжкої, резистентної до лікування гіпертензії.[20] Активація епітеліальних натрієвих каналів призводить до неадекватної затримки натрію на рівні збиральних проток нирок. В пацієнтів з синдромом Ліддла найчастіше спостерігають об'єм-залежну, низькоренінну, та низькоальдостеронну гіпертензію. Скринінги загальної гіпертензивної популяції демонструють, що синдром Ліддла є рідкісним та не робить значного внеску в загальну частоту гіпертензії серед населення.[21]
Вегетативна нервова система ред.
Вегетативна нервова система грає центральну роль в підтриманні серцево-судинного гомеостазу через тиск, об'ємні, та хеморецепторні сигнали. Це відбувається шляхом модуляції судинної системи та функції нирок, що впливає на серцевий викид, гемодинамічний опір судин, та затримання рідини в організмі. Проблеми з цією системою, такі як надлишкова активність симпатичної нервової системи, підвищують кров'яний тиск та роблять свій внесок до розвитку гіпертензії.[22][23][24][25] До того ж, збільшена симпатична активність, що супроводжується зниженою парасимпатичною активністю пов'язана з багатьма метаболічними та гемодинамічними порушеннями, які призводять до підвищення серцево-судинної захворюваності та смертності.[24][26]
Механізми підвищеної активності симпатичної нервової системи при гіпертензії є комплексними та включають патологічні зміни в барорефлективних та хеморефлективних шляхах саморегуляції одночасно на периферійному та центральному рівнях. Артеріальні барорецептори перенастроюються на високий тиск як на нормальний для гіпертензивних пацієнтів, та ця периферійна перенастройка повертається до нормальної лише коли артеріальний тиск стає контрольовано-нормальним.[8][27][28] Більше того, існує центральне перенастроювання аортального барорефлексу в гіпертензивних пацієнтів, що призводить до пригнічення симпатичної інгібіції після активації нервів аортальних барорецепторів. Існують ознаки того, що таке перенастроєння барорефлексу відбувається, принаймні частково, центральною дією ангіотензину II.[29][30][31] Іншим низькомолекулярним медіатором, який пригнічує барорецепторну активність та робить внесок до патологічного симпатичного впливу на розвиток гіпертензії є активні форми кисню та ендотелін.[32][33] Деякі дослідження показують, що гіпертензивні пацієнти проявляють більшу вазоконстрикторну відповідь на інфузії норадреналіну, ніж пацієнти з нормотензивної контрольної групи.[34] Також такі гіпертензивні пацієнти не проявляють нормальної відповіді на збільшення циркулюючого рівня норадреналіну, який в цілому викликає зниження активації норадреналінергічних рецепторів, та вважається, що така патологічна відповідь є генетично успадкована.[35]
Дія стресу збільшує симпатичну імпульсацію, та викликає повторювану стрес-індуковану вазоконстрикцію, що може викликати судинну гіпертрофію, що веде до прогресивного збільшення периферійного судинного опору та кров'яного тиску.[2] Це може частково пояснити більшу захворюваність на гіпертензію в нижніх соціоекономічних групах, оскільки вони піддаються більшим рівням стресу, що пов'язаний з повсякденним життям. Особи з сімейним анамнезом гіпертензії проявляють збільшену вазоконстрикторну та симпатичну відповідь на експериментальні стресори, такі як холодне пресорне тестування та ментальний стрес, що може визначити їх схильність до гіпертензії. Це особливо проявляється у випадку афроамериканців. Патологічна стресова відповідь робить особливо великий внесок у підвищену захворюваність на гіпертензію в цій групі.[36]
Ренін-ангіотензин-альдостеронова система ред.
Інша система, що підтримує екстрацелюлярний об'єм рідини, периферійний опір судин та у випадку порушення функції може призводити до гіпертензії, є ренін-агіотензин-альдостеронова система. Ренін є циркулюючим ферментом що бере участь в керуванні розміром екстрацелюлярного об'єму, та артеріальної вазоконстрикції. Так він робить значний внесок в регуляцію кров'яного тиску, діючи через (гідроліз) ангіотензиногену, що секретується печінкою, утворюючи пептид ангіотензин I, Ангіотензин I, який в свою чергу далі розщеплюється ферментом, що знаходиться в основному (але не виключно) в легеневому колі кровообігу у зв'язаному з ендотелієм, вигляді. Цей фермент зветься ангіотензин-перетворюючим ферментом (АПФ, ACE) і відповідає за вироблення ангіотензину II, найбільш вазоактивного пептиду.[37][38] Ангіотензин II є сильним констриктором всіх кров'яних судин. Він діє на м'язи артерій та цим збільшує периферійний опір судин, через що збільшує кров'яний тиск. Ангіотензин II також діє на наднирники та стимулює виділення Альдостерону, який стимулює збільшення реабсорбції солі і води епітеліальними клітинами нирок, що веде до збільшення об'єму крові і збільшення кров'яного тиску. Таким чином збільшення рівню реніну в крові, який у дорослих в нормі становить 1,98—24,6 нг/л у положенні стоячи.[39] призводить до гіпертензії.[2][40]
Останні дослідження стверджують, що ожиріння є фактором ризику для гіпертензії через активацію ренін-ангіотензинової системи (RAS) в жировій тканині,[41][42] і також є пов'язаним з ренін-ангіотензиновою системою через інсулінову резистентність, та доводять, що будь-яке з цих двох може викликати інше.[43] Локальне вироблення ангіотензину II в різних тканинах, включаючи кровоносні судини, серце, наднирники, і мозок, контролюється АПФ і іншими ферментами, включаючи серинову протеазе хімази. Активність локальних ренін-ангіотензинових систем та альтернативних шляхів утворення ангіотензину ІІ можуть зробити важливий внесок в ремоделювання опору судин і розвитку пошкодження органів-мішеней (наприклад, ліво-шлуночкова гіпертрофія, серцева недостатність, атеросклероз, інсульт, ниркова недостатність, інфаркт міокарду, і артеріальна аневризма) в хворих на гіпертензію.[40]
Ендотеліальна дисфункція ред.
Ендотелій кров'яних судин продукує значну кількість речовин, які впливають на кровотік та, в свою чергу, піддаються впливу змін у складі крові та тиску кровотоку. Наприклад, локальна дія оксиду азоту та ендотеліну, які секретуються ендотелієм, є головним регулятором судинного тонусу та кров'яного тиску. У пацієнтів з есенціальною гіпертензією баланс між вазодилятаторами та вазоконстрикторами є порушеним, що веде до змін в ендотелії та визначає «порочне коло», яке робить свій внесок до підтримання високого кров'яного тиску. У пацієнтів з гіпертензією активація та пошкодження ендотелію також веде до змін в тонусі судин, судинній реактивності, та каскадах зсідання крові і фібринолізу. Порушення ендотеліальної функції є надійним індикатором пошкоджень органів-мішеней і атеросклерозу, а також прогностичним фактором.[44]
Існують докази, що окисний стрес змінює багато функцій ендотелію, включаючи модуляцію вазомоторного тонусу. Є ознаки того, що інактивація оксиду азоту (NO) під дією перекису та інших активних форм кисню відбувається при таких станах як гіпертензія.[45][46][47] В нормі оксид азоту є важливим регулятором і медіатором численних процесів в нервова, імунній та серцево-судинній системах, включаючи зняття спазму гладких м'язів, що призводить до розслаблення стінок артерій та збільшення кровотоку, пригнічення міграції та проліферації судинних гладко-м'язевих клітин.[2] Існують також відомості, що ангіотензин II покращує формування окисника супероксида в концентраціях, які порушують кров'яний тиск мінімально.[48]
Ендотелін є потужним вазоактивним пептидом, що продукується ендотеліальними клітинами, які мають одночасно вазоконстрикторну та вазодилятаційну функцію. Рівні циркулюючого ендотеліну є збільшеними у деяких гіпертензивних пацієнтів,[49][49][50] особливо в афроамериканців та осіб з гіпертензією.[49][51][52][53]
Посилання ред.
- ↑ Carretero OA, Oparil S (January 2000). (Есенціальна гіпертензія. Частина І: визначення та етіологія) Essential hypertension. Part I: definition and etiology. Circulation. 101 (3): 329—35. doi:10.1161/01.CIR.101.3.329. PMID 10645931. Архів оригіналу за 7 липня 2012. Процитовано 5 червня 2009.
- ↑ а б в г д Oparil S, Zaman MA, Calhoun DA (November 2003). (Патогенез гіпертензії) Pathogenesis of hypertension. Ann. Intern. Med. 139 (9): 761—76. doi:10.7326/0003-4819-139-9-200311040-00011. PMID 14597461.
- ↑ Hall, John E.; Guyton, Arthur C. (2006). (Підручник з медичної фізіології»)Textbook of medical physiology. St. Louis, Mo: Elsevier Saunders. с. 228. ISBN 0-7216-0240-1.
- ↑ (Гіпертензія: електронний медичний вісник за напрямком нефрології) Hypertension: eMedicine Nephrology. Процитовано 5 червня 2009.
- ↑ Pierdomenico SD, Di Nicola M, Esposito AL та ін. (June 2009). (Прогностична цінність різних значень варіабельності кров’яного тиску у гіпертензивних пацієнтів) Prognostic Value of Different Indices of Blood Pressure Variability in Hypertensive Patients. American Journal of Hypertension. 22 (8): 842—7. doi:10.1038/ajh.2009.103. PMID 19498342.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Klabunde, Richard E. (2007). (Серцево-судинні концепти – Середній артеріальний тиск) Cardiovascular Physiology Concepts - Mean Arterial Pressure. Процитовано 29 вересня 2008.
- ↑ а б Corvol P, Persu A, Gimenez-Roqueplo AP, Jeunemaitre X (June 1999). Seven lessons from two candidate genes in human essential hypertension: angiotensinogen and epithelial sodium channel. Hypertension. 33 (6): 1324—31. doi:10.1161/01.hyp.33.6.1324. PMID 10373210. Архів оригіналу за 23 лютого 2013. Процитовано 8 червня 2009.
- ↑ а б Feinleib M, Garrison RJ, Fabsitz R та ін. (October 1977). The NHLBI twin study of cardiovascular disease risk factors: methodology and summary of results. American Journal of Epidemiology. 106 (4): 284—5. PMID 562066. Процитовано 8 червня 2009.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Biron P, Mongeau JG, Bertrand D (October 1976). Familial aggregation of blood pressure in 558 adopted children. Canadian Medical Association Journal. 115 (8): 773—4. PMC 1878814. PMID 974967.
- ↑ а б Lifton RP, Gharavi AG, Geller DS (February 2001). Molecular mechanisms of human hypertension. Cell. 104 (4): 545—56. doi:10.1016/S0092-8674(01)00241-0. PMID 11239411. Процитовано 8 червня 2009.
- ↑ Wilson FH, Disse-Nicodème S, Choate KA та ін. (August 2001). Human hypertension caused by mutations in WNK kinases. Science. 293 (5532): 1107—12. doi:10.1126/science.1062844. PMID 11498583. Процитовано 8 червня 2009.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Guyton AC (June 1991). Blood pressure control--special role of the kidneys and body fluids. Science. 252 (5014): 1813—6. doi:10.1126/science.2063193. PMID 2063193. Процитовано 8 червня 2009.
- ↑ Hsueh WC, Mitchell BD, Schneider JL та ін. (June 2000). QTL influencing blood pressure maps to the region of PPH1 on chromosome 2q31-34 in Old Order Amish. Circulation. 101 (24): 2810—6. doi:10.1161/01.cir.101.24.2810. PMID 10859286. Процитовано 8 червня 2009.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Levy D, DeStefano AL, Larson MG та ін. (October 2000). Evidence for a gene influencing blood pressure on chromosome 17. Genome scan linkage results for longitudinal blood pressure phenotypes in subjects from the framingham heart study. Hypertension. 36 (4): 477—83. doi:10.1161/01.hyp.36.4.477. PMID 11040222. Архів оригіналу за 23 лютого 2013. Процитовано 8 червня 2009.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Kristjansson K, Manolescu A, Kristinsson A та ін. (June 2002). Linkage of essential hypertension to chromosome 18q. Hypertension. 39 (6): 1044—9. doi:10.1161/01.HYP.0000018580.24644.18. PMID 12052839. Архів оригіналу за 23 лютого 2013. Процитовано 8 червня 2009.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Hunt SC, Ellison RC, Atwood LD, Pankow JS, Province MA, Leppert MF (July 2002). Genome scans for blood pressure and hypertension: the National Heart, Lung, and Blood Institute Family Heart Study. Hypertension. 40 (1): 1—6. doi:10.1161/01.HYP.0000022660.28915.B1. PMID 12105129. Архів оригіналу за 23 лютого 2013. Процитовано 8 червня 2009.
- ↑ Selby JV, Newman B, Quiroga J, Christian JC, Austin MA, Fabsitz RR (April 1991). Concordance for dyslipidemic hypertension in male twins. JAMA : the Journal of the American Medical Association. 265 (16): 2079—84. doi:10.1001/jama.265.16.2079. PMID 2013927.
- ↑ Niu T, Yang J, Wang B та ін. (February 1999). Angiotensinogen gene polymorphisms M235T/T174M: no excess transmission to hypertensive Chinese. Hypertension. 33 (2): 698—702. doi:10.1161/01.hyp.33.2.698. PMID 10024331. Архів оригіналу за 23 лютого 2013. Процитовано 8 червня 2009.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Luft FC (May 2000). Molecular genetics of human hypertension. Current Opinion in Nephrology and Hypertension. 9 (3): 259—66. doi:10.1097/00041552-200005000-00009. PMID 10847327. Процитовано 8 червня 2009.
- ↑ Shimkets RA, Warnock DG, Bositis CM та ін. (November 1994). Liddle's syndrome: heritable human hypertension caused by mutations in the beta subunit of the epithelial sodium channel. Cell (journal). 79 (3): 407—14. doi:10.1016/0092-8674(94)90250-X. PMID 7954808. Процитовано 8 червня 2009.
{{cite journal}}: Текст «Cell» проігноровано (довідка); Явне використання «та ін.» у:|author=(довідка) - ↑ Melander O, Orho M, Fagerudd J та ін. (May 1998). Mutations and variants of the epithelial sodium channel gene in Liddle's syndrome and primary hypertension. Hypertension. 31 (5): 1118—24. doi:10.1161/01.hyp.31.5.1118. PMID 9576123. Процитовано 8 червня 2009.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка)[недоступне посилання з липня 2019] - ↑ Somers VK, Anderson EA, Mark AL (January 1993). Sympathetic neural mechanisms in human hypertension. Current Opinion in Nephrology and Hypertension. 2 (1): 96—105. doi:10.1097/00041552-199301000-00015. PMID 7922174.
- ↑ Takahashi H (August 2008). [Sympathetic hyperactivity in hypertension]. Nippon Rinsho. Japanese Journal of Clinical Medicine (Japanese) . 66 (8): 1495—502. PMID 18700548.
- ↑ а б Esler M (June 2000). The sympathetic system and hypertension. American Journal of Hypertension. 13 (6 Pt 2): 99S—105S. doi:10.1016/S0895-7061(00)00225-9. PMID 10921528.
- ↑ Mark AL (December 1996). The sympathetic nervous system in hypertension: a potential long-term regulator of arterial pressure. Journal of Hypertension. Supplement : Official Journal of the International Society of Hypertension. 14 (5): S159—65. PMID 9120673.
- ↑ Brook RD, Julius S (June 2000). Autonomic imbalance, hypertension, and cardiovascular risk. American Journal of Hypertension. 13 (6 Pt 2): 112S—122S. doi:10.1016/S0895-7061(00)00228-4. PMID 10921530.
- ↑ Guo GB, Thames MD, Abboud FM (August 1983). Arterial baroreflexes in renal hypertensive rabbits. Selectivity and redundancy of baroreceptor influence on heart rate, vascular resistance, and lumbar sympathetic nerve activity. Circulation Research. 53 (2): 223—34. doi:10.1161/01.res.53.2.223. PMID 6883646. Процитовано 8 червня 2009.[недоступне посилання з липня 2019]
- ↑ Xie PL, Chapleau MW, McDowell TS, Hajduczok G, Abboud FM (August 1990). Mechanism of decreased baroreceptor activity in chronic hypertensive rabbits. Role of endogenous prostanoids. The Journal of Clinical Investigation. 86 (2): 625—30. doi:10.1172/JCI114754. PMC 296770. PMID 2117025.
- ↑ Lohmeier TE (June 2001). The sympathetic nervous system and long-term blood pressure regulation. American Journal of Hypertension. 14 (6 Pt 2): 147S—154S. doi:10.1016/S0895-7061(01)02082-9. PMID 11411750.
- ↑ Guo GB, Abboud FM (May 1984). Impaired central mediation of the arterial baroreflex in chronic renal hypertension. The American Journal of Physiology. 246 (5 Pt 2): H720—7. PMID 6720985. Процитовано 8 червня 2009.
- ↑ Abboud FM (February 1974). Effects of sodium, angiotensin, and steroids on vascular reactivity in man. FASEB J. 33 (2): 143—9. PMID 4359754.
- ↑ Li Z, Mao HZ, Abboud FM, Chapleau MW (October 1996). Oxygen-derived free radicals contribute to baroreceptor dysfunction in atherosclerotic rabbits. Circulation Research. 79 (4): 802—11. doi:10.1161/01.res.79.4.802. PMID 8831504. Архів оригіналу за 23 лютого 2013. Процитовано 8 червня 2009.
- ↑ Chapleau MW, Hajduczok G, Abboud FM (July 1992). Suppression of baroreceptor discharge by endothelin at high carotid sinus pressure. The American Journal of Physiology. 263 (1 Pt 2): R103—8. PMID 1636777. Процитовано 8 червня 2009.
- ↑ Ziegler MG, Mills P, Dimsdale JE (July 1991). Hypertensives' pressor response to norepinephrine. Analysis by infusion rate and plasma levels. American Journal of Hypertension. 4 (7 Pt 1): 586—91. PMID 1873013.
- ↑ Bianchetti MG, Beretta-Piccoli C, Weidmann P, Ferrier C (April 1986). Blood pressure control in normotensive members of hypertensive families. Kidney International (journal). 29 (4): 882—8. doi:10.1038/ki.1986.81. PMID 3520094.
{{cite journal}}: Текст «Kidney International» проігноровано (довідка) - ↑ Calhoun DA, Mutinga ML, Collins AS, Wyss JM, Oparil S (December 1993). Normotensive blacks have heightened sympathetic response to cold pressor test. Hypertension. 22 (6): 801—5. doi:10.1161/01.hyp.22.6.801. PMID 8244512. Архів оригіналу за 23 лютого 2013. Процитовано 9 червня 2009.
- ↑ Fujino T, Nakagawa N, Yuhki K та ін. (September 2004). Decreased susceptibility to renovascular hypertension in mice lacking the prostaglandin I2 receptor IP. J. Clin. Invest. 114 (6): 805—12. doi:10.1172/JCI21382. PMC 516260. PMID 15372104.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Brenner & Rector's The Kidney, 7th ed., Saunders, 2004. pp.2118-2119.Full Text with MDConsult subscription [Архівовано 2016-03-03 у Wayback Machine.]
- ↑ Hamilton Regional Laboratory Medicine Program — Laboratory Reference Centre Manual. Renin Direct [Архівовано 24 лютого 2012 у Wayback Machine.]
- ↑ а б McConnaughey MM, McConnaughey JS, Ingenito AJ (June 1999). Practical considerations of the pharmacology of angiotensin receptor blockers. Journal of Clinical Pharmacology. 39 (6): 547—59. doi:10.1177/00912709922008155. PMID 10354958. Архів оригіналу за 17 грудня 2019. Процитовано 9 червня 2009.
- ↑ Segura J, Ruilope LM (October 2007). Obesity, essential hypertension and renin-angiotensin system. Public Health Nutrition. 10 (10A): 1151—5. doi:10.1017/S136898000700064X. PMID 17903324. Процитовано 2 червня 2009.
- ↑ Hasegawa H, Komuro I (April 2009). [The progress of the study of RAAS]. Nippon Rinsho. Japanese Journal of Clinical Medicine (Japanese) . 67 (4): 655—61. PMID 19348224.
- ↑ Saitoh S (April 2009). [Insulin resistance and renin-angiotensin-aldosterone system]. Nippon Rinsho. Japanese Journal of Clinical Medicine (Japanese) . 67 (4): 729—34. PMID 19348235.
- ↑ O'Brien, Eoin; Beevers, D. G.; Lip, Gregory Y. H. (2007). ABC of hypertension. London: BMJ Books. ISBN 1-4051-3061-X.
- ↑ Nakazono K, Watanabe N, Matsuno K, Sasaki J, Sato T, Inoue M (November 1991). Does superoxide underlie the pathogenesis of hypertension?. Proceedings of the National Academy of Sciences of the United States of America. 88 (22): 10045—8. doi:10.1073/pnas.88.22.10045. PMC 52864. PMID 1658794.
- ↑ Laursen JB, Rajagopalan S, Galis Z, Tarpey M, Freeman BA, Harrison DG (February 1997). Role of superoxide in angiotensin II-induced but not catecholamine-induced hypertension. Circulation (journal). 95 (3): 588—93. doi:10.1161/01.cir.95.3.588. PMID 9024144. Архів оригіналу за 23 лютого 2013. Процитовано 9 червня 2009.
{{cite journal}}: Текст «Circulation» проігноровано (довідка) - ↑ Cai H, Harrison DG (November 2000). Endothelial dysfunction in cardiovascular diseases: the role of oxidant stress. Circulation Research. 87 (10): 840—4. doi:10.1161/01.res.87.10.840. PMID 11073878. Архів оригіналу за 23 лютого 2013. Процитовано 9 червня 2009.
- ↑ Fukui T, Ishizaka N, Rajagopalan S та ін. (January 1997). p22phox mRNA expression and NADPH oxidase activity are increased in aortas from hypertensive rats. Circulation Research. 80 (1): 45—51. PMID 8978321. Архів оригіналу за 23 лютого 2013. Процитовано 9 червня 2009.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ а б в Touyz RM, Schiffrin EL (June 2003). Role of endothelin in human hypertension. Canadian Journal of Physiology and Pharmacology. 81 (6): 533—41. doi:10.1139/y03-009. PMID 12839265. Архів оригіналу за 16 грудня 2012. Процитовано 9 червня 2009.
- ↑ Shreenivas S, Oparil S (2007). The role of endothelin-1 in human hypertension. Clinical Hemorheology and Microcirculation. 37 (1–2): 157—78. PMID 17641406. Архів оригіналу за 12 березня 2020. Процитовано 9 червня 2009.
- ↑ Ergul S, Parish DC, Puett D, Ergul A (October 1996). Racial differences in plasma endothelin-1 concentrations in individuals with essential hypertension. Hypertension. 28 (4): 652—5. doi:10.1161/01.hyp.28.4.652. PMID 8843893. Архів оригіналу за 23 лютого 2013. Процитовано 9 червня 2009.
- ↑ Grubbs AL, Ergul A (2001). A review of endothelin and hypertension in African-American individuals. Ethnicity & Disease. 11 (4): 741—8. PMID 11763297.
- ↑ Campia U, Cardillo C, Panza JA (June 2004). Ethnic differences in the vasoconstrictor activity of endogenous endothelin-1 in hypertensive patients. Circulation (journal). 109 (25): 3191—5. doi:10.1161/01.CIR.0000130590.24107.D3. PMID 15148269. Процитовано 9 червня 2009.
{{cite journal}}: Текст «Circulation» проігноровано (довідка)