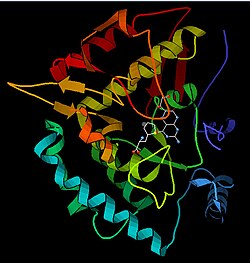
Фенілаланінгідроксилаза
білок людини
Фенілаланінгідроксилаза (англ. Phenylalanine hydroxylase, PAH) — білок, який кодується геном PAH, розташованим у людей на короткому плечі 12-ї хромосоми.[5] Довжина поліпептидного ланцюга білка становить 452 амінокислот, а молекулярна маса — 51 862[6].
Послідовність амінокислот
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MSTAVLENPG | LGRKLSDFGQ | ETSYIEDNCN | QNGAISLIFS | LKEEVGALAK | ||||
| VLRLFEENDV | NLTHIESRPS | RLKKDEYEFF | THLDKRSLPA | LTNIIKILRH | ||||
| DIGATVHELS | RDKKKDTVPW | FPRTIQELDR | FANQILSYGA | ELDADHPGFK | ||||
| DPVYRARRKQ | FADIAYNYRH | GQPIPRVEYM | EEEKKTWGTV | FKTLKSLYKT | ||||
| HACYEYNHIF | PLLEKYCGFH | EDNIPQLEDV | SQFLQTCTGF | RLRPVAGLLS | ||||
| SRDFLGGLAF | RVFHCTQYIR | HGSKPMYTPE | PDICHELLGH | VPLFSDRSFA | ||||
| QFSQEIGLAS | LGAPDEYIEK | LATIYWFTVE | FGLCKQGDSI | KAYGAGLLSS | ||||
| FGELQYCLSE | KPKLLPLELE | KTAIQNYTVT | EFQPLYYVAE | SFNDAKEKVR | ||||
| NFAATIPRPF | SVRYDPYTQR | IEVLDNTQQL | KILADSINSE | IGILCSALQK | ||||
| IK |
Кодований геном білок за функціями належить до оксидоредуктаз, фосфопротеїнів. Білок має сайт для зв'язування з іоном заліза.
Фермент додає гідроксильну групу до молекули фенілаланіну, утворюючи іншу амінокислоту — тирозин. У випадку дефекту роботи ферменту розвивається захворювання фенілкетонурія, зазвичай спадкове.
Література
ред.- Kwok S.C.M., Ledley F.D., Dilella A.G., Robson K.J.H., Woo S.L.C. (1985). Nucleotide sequence of a full-length complementary DNA clone and amino acid sequence of human phenylalanine hydroxylase. Biochemistry. 24: 556—561. PMID 2986678 DOI:10.1021/bi00324a002
- The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC). Genome Res. 14: 2121—2127. 2004. PMID 15489334 DOI:10.1101/gr.2596504
- Cotton R.G., McAdam W., Jennings I., Morgan F.J. (1988). A monoclonal antibody to aromatic amino acid hydroxylases. Identification of the epitope. Biochem. J. 255: 193—196. PMID 2461704 DOI:10.1042/bj2550193
- Siltberg-Liberles J., Steen I.H., Svebak R.M., Martinez A. (2008). The phylogeny of the aromatic amino acid hydroxylases revisited by characterizing phenylalanine hydroxylase from Dictyostelium discoideum. Gene. 427: 86—92. PMID 18835579 DOI:10.1016/j.gene.2008.09.005
- Erlandsen H., Flatmark T., Stevens R.C., Hough E. (1998). Crystallographic analysis of the human phenylalanine hydroxylase catalytic domain with bound catechol inhibitors at 2.0-A resolution. Biochemistry. 37: 15638—15646. PMID 9843368 DOI:10.1021/bi9815290
- Fusetti F., Erlandsen H., Flatmark T., Stevens R.C. (1998). Structure of tetrameric human phenylalanine hydroxylase and its implications for phenylketonuria. J. Biol. Chem. 273: 16962—16967. PMID 9642259 DOI:10.1074/jbc.273.27.16962
Примітки
ред.- ↑ Захворювання, генетично пов'язані з PAH переглянути/редагувати посилання на ВікіДаних.
- ↑ Сполуки, які фізично взаємодіють з Фенілаланінгідроксилаза переглянути/редагувати посилання на ВікіДаних.
- ↑ Human PubMed Reference:.
- ↑ Mouse PubMed Reference:.
- ↑ HUGO Gene Nomenclature Commitee, HGNC:8582 (англ.) . Архів оригіналу за 18 жовтня 2018. Процитовано 11 вересня 2017.
- ↑ UniProt, P00439 (англ.) . Процитовано 11 вересня 2017.
Див. також
ред.| Це незавершена стаття про білки. Ви можете допомогти проєкту, виправивши або дописавши її. |