Пентафторид стибію
Пентафторид стибію — неорганічна сполука з хімічною формулою SbF5. Ця безбарвна в’язка рідина є сильною кислотою Льюїса та є компонентом фторантимонової кислоти — суперкислоти, що утворюється при змішуванні рідкого фтороводню з рідким пентафторидом стибію у співвідношенні 1:1. Він відрізняється здатністю реагувати практично з усіма відомими сполуками.[1]
| Пентафторид стибію | |
|---|---|
 |
 |
| Назва за IUPAC | Пентафторид стибію |
| Систематична назва | Пентафтор-λ5-стибан |
| Інші назви | Стибій(V) фторид, пентафторидоантимон |
| Ідентифікатори | |
| Номер CAS | 7783-70-2 |
| PubChem | 24557 |
| Номер EINECS | 232-021-8 |
| RTECS | CC5800000 |
| SMILES | F[Sb](F)(F)(F)F |
| InChI | 1/5FH.Sb/h5*1H;/q;;;;;+5/p-5/rF5Sb/c1-6(2,3,4)5 |
| Властивості | |
| Молекулярна формула | SbF5 |
| Молярна маса | 216.74 г/моль |
| Зовнішній вигляд | безбарвна масляниста в'язка рідина, гігроскопічна |
| Запах | гострий, різкий |
| Густина | 2.99 г/см3 |
| Тпл | 8.3 |
| Розчинність (вода) | Реагує |
| Розчинність | розчинний у фториді калію, у рідкому діоксиду сірки |
| Небезпеки | |
| ГДК (США) | TWA 0,5 мг/м3 (Стибій) |
| ЛД50 | 270 мг/кг (миша, підшкірно) |
| ГГС піктограми |      
|
| ГГС формулювання небезпек | 300+310+330, 314, 411, 412 |
| ГГС запобіжних заходів | 260, 261, 264, 270, 271, 273, 280, 301+312, 301+330+331, 303+361+353, 304+312, 304+340, 305+351+338, 310, 312, 321, 330, 363, 391, 405, 501 |
| Головні небезпеки | Надзвичайно токсичний, їдкий, небезпечний для здоров'я. Вивільняє флуоридну кислоту при контакті з водою та біологічними тканинами. Сильний окислювач. |
| NFPA 704 | |
| Температура спалаху | незаймистий |
| Пов'язані речовини | |
| Інші аніони | Пентахлорид стибію |
| Інші катіони | Пентафторид фосфору Пентафторид арсену Пентафторид бісмуту |
| Пов'язані речовини | Трифторид стибію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Підготовка ред.
Пентафторид стибію отримують реакцією пентахлориду стибію з безводним фтороводнем:[2]
- SbCl5 + 5HF → SbF5 + 5HCl
Його також можна приготувати з трифториду стибію та фтору.[3]
Будова та хімічні реакції ред.
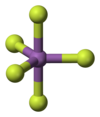
У газовій фазі пентафторид стибію приймає тригональну біпірамідальну структуру D3h точкової групи симетрії (див. малюнок). Речовина приймає більш складну структуру в рідкому і твердому станах. Рідина містить полімери, у яких кожен стибій є октаедричним, структуру описують формулою [SbF4(μ-F)2]n ((μ-F) вказує на той факт, що фторидні центри сполучають два центри стибію). Кристалічний матеріал є тетрамером, що означає, що він має формулу [SbF4(μ-F)]4. Зв'язки стибію та фтору становлять 2,02 Å у восьмичленному кільці Sb4F4; інші фторидні ліганди, що випромінюються від чотирьох центрів стибію, коротші на 1,82 Å.[4] Пов'язані речовини пентафторид фосфору та пентафторид арсену є мономерними у твердому та рідкому станах, ймовірно, через менші розміри центрального атома, що обмежує їх координаційне число. Пентафторид бісмута є полімером.[5]
Пентафторид стибію окислює кисень у присутності фтору:[6]
- 2SbF5 + F2 + 2O2 → 2[O2]+[SbF6]−
Пентафторид стибію сам по собі також є дуже сильним окиснювачем. Фосфор при контакті з ним горить.
SbF5 також використовувався в першій відкритій хімічній реакції, яка утворює газоподібний фтор із сполук фтору:
- 4SbF5 + 2K2MnF6 → 4KSbF6 + 2MnF3 + F2
Рушійною силою цієї реакції є висока спорідненість пентафториду стибію до F−, що є тією самою властивістю, що рекомендує використання SbF5 для генерування суперкислот.
Гексафторантимонат ред.
SbF5 є сильною кислотою Льюїса, винятково по відношенню до джерел F−, утворюючи дуже стабільний аніон [SbF6]−, який називається гексафторантимонат. Це сполучена основа суперкислоти фторантимонова кислота. [SbF6]− є слабокоординаційним аніоном, подібним до PF6−. Незважаючи на те, що [SbF6]– є слабкоосновною, вона реагує з додатковим SbF 5, утворюючи центросиметричний аддукт:
- SbF5 + [SbF6]− → [Sb2F11]−
Аніон [Sb2F11]- є одним із іонів, які містяться в суміші фторантимонової кислоти.
Безпека ред.
Пентафторид стибію бурхливо реагує з водою. Він реагує з багатьма сполуками, часто вивільняючи небезпечний фтороводень. Він дуже токсичний і їдкий для шкіри та очей. Сильний окиснювач.[7][8]
Примітки ред.
- ↑ Olah, G. A.; Prakash, G. K. S.; Wang, Q.; Li, X.-y.
- ↑ Sabina C. Grund, Kunibert Hanusch, Hans J. Breunig, Hans Uwe Wolf "Antimony and Antimony Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim DOI:10.1002/14356007.a03_055.pub2
- ↑ Handbook of Preparative Inorganic Chemistry, 2nd Ed.
- ↑ Edwards, A. J.; Taylor, P. "Crystal structure of Antimony Pentafluoride" Journal of the Chemical Society, Chemical Communications 1971, pp. 1376-7.DOI:10.1039/C29710001376
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5
- ↑ Shamir, J.; Binenboym, J. "Dioxygenyl Salts" Inorganic Syntheses 1973, XIV, 109-122. ISSN 0073-8077
- ↑ International Programme on Chemical Safety (2005). Antimony pentafluoride. Commission of the European Communities (CEC). Процитовано 10 травня 2010.
- ↑ Barbalace, Kenneth (2006). Chemical Database - Antimony Pentafluoride. Environmental Chemistry. Процитовано 10 травня 2010.
