Шлях PI3K/AKT/mTOR
Шлях PI3K/AKT/mTOR ― це внутрішньоклітиний сигнальний шлях, який є важливим у регуляції клітинного циклу. Тому він безпосередньо пов'язаний зі станом спокою клітин, проліферацією, раком і довголіттям. Активація PI3K фосфорилює та активує AKT, локалізуючи його в плазматичній мембрані.[1] AKT може мати низку ефектів, таких як активація CREB,[2] інгібування p27,[3] локалізація FOXO в цитоплазмі,[3] активація PtdIns-3ps[4] та mTOR[3], що може впливати на транскрипцію p70 або 4EBP1.[3] Існує багато відомих факторів, які посилюють шлях PI3K/AKT, включаючи EGF,[5] shh,[2] IGF-1,[2] інсулін[3] та CaM.[4] Лептин та інсулін залучають сигналізацію PI3K для регуляції метаболізму.[6] Цей шлях пригнічують різні фактори, зокрема PTEN,[7] GSK3B[2] і HB9.[5]
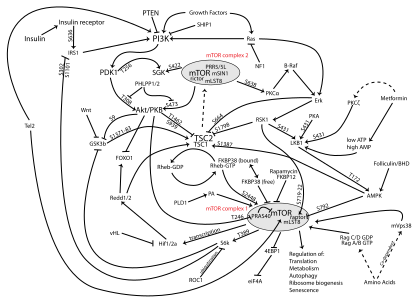
У багатьох видах раку цей шлях надмірно активний, що веде до зменшення апоптозу і сприяє проліферації. Однак він необхідний, щоб сприяти росту та проліферації, а не диференціації дорослих стовбурових клітин, зокрема нейронних стовбурових клітин .[2] Дослідники намагаються знайти відповідне співвідношення між проліферацією та диференціюванням, щоб використовувати цей баланс у розробці різних методів лікування.[2] Крім того, було встановлено, що цей шлях є необхідним компонентом довготривалої потенціації нервової системи.[4][8]
Проліферація нервових стовбурових клітин
ред.Відповідь на глюкозу
ред.Нервові стовбурові клітини (НСК) у мозку повинні знайти баланс між збереженням своєї мультипотентності шляхом самооновлення та проліферації на противагу диференціюванню та стану спокою. Шлях PI3K/AKT має вирішальне значення в цьому процесі прийняття рішень. НСК здатні відчувати та реагувати на зміни в мозку або в усьому організмі. Коли рівень глюкози в крові різко підвищується, інсулін вивільняється з підшлункової залози. Активація рецепторів інсуліну активує шлях PI3K/AKT, що сприяє проліферації.[3] Таким чином, коли в організмі є високий рівень глюкози та надлишок енергії, активується шлях PI3K/AKT і НСК мають тенденцію до проліферації. Коли низька кількість доступної енергії, шлях PI3K/AKT менш активний і клітини переходять у стан спокою. Частково це відбувається, коли АКТ фосфорилює FOXO, утримуючи FOXO в цитоплазмі.[3] Після дефосфорилювання FOXO може проникати в ядро і працювати як фактор транскрипції для сприяння експресії різних супресорів пухлин, таких як p27 і p21.[3] Ці пухлинні супресори підштовхують НСК до переходу в стан спокою. При нокауті FOXO клітини втрачають здатність переходити в стан спокою, а також втрачають свій характер нейронних стовбурових клітин, можливо, переходять в раковий стан.[3]
PTEN
ред.Шлях PI3K/AKT має природний інгібітор під назвою фосфатаза та гомолог тензину (PTEN), функція якого полягає в обмеженні проліферації в клітинах, допомагаючи запобігти раку. Показано, що нокаут PTEN збільшує масу мозку через нерегульовану проліферацію.[3] PTEN працює шляхом дефосфорилювання PIP3 до PIP2, що обмежує здатність AKT зв'язуватися з мембраною, знижуючи її активність. Дефіцит PTEN може компенсуватись далі у шляху, щоб підтримати диференціацію або стан спокою. З цієї причини нокаут PTEN не є настільки серйозним, як нокаут FOXO.[3]
CREB
ред.Елемент відповіді цАМФ CREB тісно пов'язаний з рішенням клітини проліферувати чи ні. Клітини, які змушені інгібітор mTOR рапаміцин показав пригнічення росту пухлини на 77-99 %інгібітор mTOR рапаміцин показав пригнічення росту пухлини на 77-99 %надмірно експресувати AKT, збільшують кількість CREB і проліферацію порівняно з клітинами дикого типу. Ці клітини також менше експресують маркери гліальних і нервових клітин, такі як GFAP або β-тубулін.[2] Це пояснюється тим, що CREB є фактором транскрипції, який впливає на транскрипцію цикліну А, який сприяє проліферації.[2] Наприклад, дорослим нейронним клітинам-попередникам гіпокампа потрібна перерва як стовбуровим клітинам, щоб диференціюватися пізніше. Це регулюється Shh . Shh працює через залежність від повільного синтезу білка, що стимулює інші каскади, які діють синергетично з шляхом PI3K/AKT, щоб індукувати проліферацію. Далі інший шлях може бути вимкнутий і ефекти шляху PI3K/AKT стають недостатніми для зупинки диференціювання.[2] Специфіка цього шляху невідома.
Роль у розвитку раку
ред.Рак яєчників
ред.Шлях PI3K/AKT/mTOR є центральним регулятором раку яєчників. PIM-кінази надмірно експресуються в багатьох типах раку, і вони також беруть участь у регуляції раку яєчників. Встановлено, що PIM прямо чи опосередковано активує mTOR та його попередні ефектори, такі як AKT. Крім того, PIM-кінази можуть викликати фосфорилювання IRS, що може змінювати PI3K. Це свідчить про тісну взаємодію PIM із каскадом PI3K/ AKT/mTOR та його компонентами. Подібним чином повідомлялося, що AKT здійснює фосфорилювання BAD у клітинах раку яєчників. PIM і мережа PI3K/AKT/mTOR можуть пригнічувати експресію P21 і P27 в клітинах раку єячників. Ці дані свідчать про значну можливість взаємодії та актуальність кіназ PIM і мережі PI3K/AKT/mTOR у регуляції раку яєчників.[9] Однак визначення цього шляху при раку яєчників було складним завданням, оскільки кілька досліджень не змогли досягти достатнього клінічного успіху.[10][11]
Рак молочної залози
ред.У багатьох видах раку молочної залози відхилення шляху PI3K/AKT/mTOR є найпоширенішими геномними аномаліями. Найпоширеніші відомі відхилення включають мутацію гена PIK3CA та мутації втрати функції або епігенетичний сайленсинг PTEN.[12] Шлях фосфоінозитид-3-кінази (PI3K)/протеїнкінази B (AKT)/мішені рапаміцину у ссавців (mTOR) активується приблизно в 30–40 % випадків раку молочної залози. При потрійному негативному раку молочної залози (ПНРМЗ) онкогенна активація шляху PI3K/AKT/mTOR може відбутися внаслідок гіперекспресії висхідних регуляторів, таких як EGFR, активації мутацій PIK3CA, втрати функції або експресії фосфатази та гомолога тензину (PTEN), а також багату проліном інозитолполіфосфатазу, яка знижує рівень PI3K.[13] Це узгоджується з гіпотезою про те, що інгібітори PI3K можуть подолати резистентність до ендокринної терапії, якщо вона набута.
Уротеліальний рак
ред.Мутації PIK3CA часто призводять до посилення функції при уротеліальному раку.[14] Подібно до PI3Ka, PI3Kb експресується в багатьох різних клітинах і в основному бере участь в активації тромбоцитів і розвитку тромботичних захворювань. Дослідження показали, що PI3Kb також сприяє проліферації пухлини. Зокрема, він відіграє важливу роль у пухлиногенезі при PTEN-негативних ракових захворюваннях.[15] Повідомляється, що втручання в ген PI3Kb може бути терапевтичним підходом до раку сечового міхура високого ризику з мутантним PTEN і втратою E-кадгерину. Специфічні інгібітори ізоформ PI3Kb є потенційним засобом лікування раку з дефіцитом PTEN.[16]
Рак простати
ред.Шлях PI3K є основним джерелом стійкості до ліків при раку простати. Особливо це стосується стійкого до кастраційно-резистентного раку передміхурової залози, коли пухлини стають стійкими до андрогенної деприваційної терапії, яка блокує здатність пухлини використовувати гормон андроген для росту.[17] Це пов'язано зі складним механізмом зворотного зв'язку, який існує між рецептором андрогенів і шляхом PI3K.[18] Як і в інших типах пухлин, мутації в ключових генах цього шляху можуть призвести до гіперактивації цього шляху, наприклад, у PIK3CA,[19][20] Збільшення кількості копій PIK3CA та підвищення експресії мРНК також посилює активацію шляху при раку передміхурової залози.[21] Було показано, що збільшення в сусідньому генетичному регіоні 3q26.31-32 відбувається одночасно з низкою найближчих членів родини PI3K, включаючи PIK3CA, PIK3CB і PIK3R4, що призводить до транскрипційних змін у PIK3C2G, PIK3CA, PIK3CB, PIK3R4, а також пов'язаних шляхів з проліферацією клітин.[22] Ці широкомасштабні зміни пов'язані зішкалою Глісона, стадією пухлини, метастазами в лімфатичних вузлах та іншими агресивними клінічними ознаками.[22] У пацієнтів, які отримували інгібітори PI3K, ті, у кого збільшилася кількість копій PIK3CB, мають підвищену чутливість до препарату.[23]
Терапія
ред.Інгібітор PI3K
ред.Інгібітори PI3K можуть подолати стійкість до ліків і покращити результати лікування прогресуючого раку молочної залози.[12] Різні інгібітори PI3K виявляють різну дію проти різних типів PI3K. Інгібітори пан-PI3K класу IA були більш детально вивчені, ніж ізоформні інгібітори; Піктілісіб є ще одним інгібітором пан-PI3K з більшою активністю субодиничною α-інгібіторною активністю, ніж бупарлізиб.[13] Іделалізиб є першим інгібітором PI3K, схваленим Управлінням з санітарного нагляду за якістю харчових продуктів і медикаментів США, який використовується для лікування рецидивуючої/резистентної хронічної лімфоцитарної лейкемії/малої лімфоцитарної лімфоми та фолікулярної лімфоми. Копанлізиб схвалений для лікування рецидиву фолікулярної лімфоми у пацієнтів, які пройшли принаймні дві системні терапії.[24] Дувелісіб схвалений для лікування рецидивуючої/резистентної хронічної лімфолейкемії /малої лімфоцитарної лімфоми і рецидивуючої/рефрактерної фолікулярної лімфом:, обидва показання для пацієнтів, які отримували щонайменше дві попередні терапії.[25]
Інгібітор AKT
ред.AKT знаходиться нижче у шляху за PI3K і інгібується Іпатасертибом.[13] AKT є кіназою сімейства AGC і центральним інтегральним сигнальним вузлом шляху PAM . Існує три ізоферменти AKT, а саме: AKT1, AKT2 і AKT3. Маленькі молекулярні інгібітори AKT1 можуть бути особливо корисними для націлювання на пухлини з високою поширеністю мутацій, що активують AKT1 E17K, які спостерігаються у 4–6 % раку молочної залози та 1–2 % колоректального раку.[26] Дослідження щодо інгібування AKT зосереджено на інгібуванні двох окремих сайтів зв'язування:
- алостерична кишеня неактивного ферменту;
- сайт зв'язування АТФ.
Алостеричні інгібітори AKT, виділені MK-2206, були ретельно оцінені в клінічних умовах. Нещодавно були ідентифіковані додаткові алостеричні інгібітори AKT. ARQ-092 є потужним pan-AKT інгібітором, який може пригнічувати ріст пухлини доклінічним шляхом і зараз знаходиться на етапі I клінічних досліджень.[26]
Інгібітор mTOR
ред.Існує суттєва кореляція фосфорильованого mTOR з виживаністю пацієнтів із I та II стадією потрійного негативного раку молочної залози (ПНРМЗ). На ксенотрансплантантній моделі ПНРМЗ пацієнта, інгібітор mTOR показав пригнічення росту пухлини на 77–99 %, що значно більше, ніж при лікуванні Доксорубіцином. Дослідження фосфорилювання білка показали, що конститутивна активація шляху mTOR зменшилася під час лікування.[13]
Подвійні інгібітори PI3K/AKT/mTOR
ред.Було припущено, що блокування шляху PI3K/AKT/mTOR може призвести до підвищення протипухлинної активності в ПНРМЗ. Доклінічні дані показали, що комбінація сполук, націлених на різні споріднені молекули в шляху PI3K/AKT/mTOR, призводить до синергічної активності. На основі цих висновків продовжують розроблятися нові сполуки, які одночасно діють на різні компоненти шляху PI3K/AKT/mTOR. Наприклад, Гедатолісіб інгібує мутантні форми PI3K-α з підвищеною активністю кінази в концентраціях, еквівалентних IC50 для PI3K-α дикого типу. Ізоформи PI3K-β, -δ і -γ були інгібовані Гедатолісібом у концентраціях приблизно в 10 разів вищих, ніж ті, що спостерігалися для PI3K-α.[13] Ще однією перевагою одночасного впливу на PI3K та mTOR є більш сильне пригнічення рецепторних тирозинкіназно-позитивних петель зворотного зв'язку, що спостерігається при ізольованому інгібуванні PI3K.[27] Гедатолізиб знаходиться на стадії розробки для лікування ТНДКРЛ у комбінації з кон'югатом антитіло-лікарський препарат PTK7. Апітолісіб (GDC-0980) є інгібітором PI3K (субодиниці α, δ і γ), який також діє на mTORC[28].
Ко-таргетна терапія шляху PI3K
ред.Існують численні клітинні сигнальні шляхи, які виявляють перехресні зв'язки з шляхом PI3K, що потенційно дозволяє раковим клітинам уникати інгібування PI3K.[29] Таким чином, інгібування шляху PI3K разом з іншими мішенями може запропонувати синергетичну реакцію, таку як та, що спостерігається при спільному інгібуванні PI3K і MEK у клітинах раку легенів.[30] Зовсім недавно було запропоновано спільне націлювання на шлях PI3K з кіназами PIM, численні доклінічні дослідження свідчать про потенційну користь цього підходу.[31][32] Розробка панелей клітинних ліній, які є стійкими до інгібування шляху PI3K, може призвести до ідентифікації майбутніх спільних мішеней і кращого розуміння того, які шляхи можуть компенсувати втрату сигналізації PI3K після медикаментозного лікування.[33] Поєднання інгібування PI3K з більш традиційними методами лікування, такими як хіміотерапія, також може забезпечити кращу відповідь, ніж інгібування тільки PI3K.[34]
Нервові стовбурові клітини (НСК)
ред.Тип сигналізації фактора росту може впливати на те, чи диференціюються НСК у мотонейрони, чи ні. Праймування середовища FGF2 знижує активність шляху PI3K/AKT, який активує GSK3β. Це збільшує експресію HB9.[5] Пряме інгібування PI3K у НСК призводить до популяції клітин, які є суто HB9+ і диференціюються з підвищеною ефективністю в моторні нейрони. Трансплантація цих клітин до різних частин щурів генерує моторні нейрони незалежно від мікрооточення трансплантованих клітин.[5] Після пошкодження нервові стовбурові клітини переходять у фазу відновлення та експресують високі рівні PI3K для посилення проліферації. Це краще для виживання нейронів в цілому, але за рахунок створення рухових нейронів. Тому пошкодженим руховим нейронам може бути важко відновити свою здатність.[5] Метою сучасних досліджень є створення нейронних стовбурових клітин, які можуть проліферувати, але все ще диференціюватися в рухові нейрони. Зниження ефекту шляху PI3K і посилення ефекту GSK3β і HB9 в НСК є потенційним способом генерації цих клітин.[5]
Інгібітори PTEN
ред.PTEN є супресором пухлин, який пригнічує шлях PI3K/AKT. Інгібітори PTEN, такі як Біспероксованадій[35], можуть посилити шлях PI3K/AKT для сприяння клітинній міграції,[36] виживанню[37] та проліферації.[7] Хоча існують певні занепокоєння щодо можливої порушення регуляції клітинного циклу та пухлиногенезу, тимчасове та помірне інгібування PTEN може забезпечити нейропротекторію від черепно-мозкової травми[38] та покращити відновлення ЦНС за рахунок відновлення втрачених зв'язків шляхом аксоногенезу .[7] Медична цінність інгібіторів PTEN ще не визначена.
Довготривале потенціювання
ред.Для того, щоб відбулася довготривала потенціація (ДТП), необхідна стимуляція NMDA-рецепторів, що спричиняє постсинаптичну вставку AMPA-рецепторів . PI3K зв'язується з рецепторами AMPA в консервативному регіоні, щоб орієнтувати рецептори в мембрані, зокрема на субодиниці GluR.[4] Активність PI3K підвищується у відповідь на іони кальцію та CaM . Крім того, AKT локалізує PtdIns-3P у постсинапсі, який залучає докинг-білки, такі як tSNARE і Vam7. Це безпосередньо призводить до приєднання AMPA до постсинапсу.[4] mTOR активує p70S6K та інактивує 4EBP1, що змінює експресію генів, щоб дозволити відбутися ДТП.[8] У щурів це вплинуло на довготривале тренування кондиціонування страху, але не вплинуло на короткострокове кондиціонування. Зокрема, було втрачено обумовлення страху мигдалини. Це тип слідового обумовлення, який є формою навчання, що вимагає асоціації умовного стимулу з безумовним стимулом. Цей ефект був втрачений при нокдауні PI3K і посилився при надмірній експресії PI3K.[8]
Роль у розвитку мозку
ред.Окрім описаної вище ролі в синаптичній пластичності, сигнальний шлях PI3K-AKT також відіграє важливу роль у зростанні мозку, який змінюється, коли порушується передача сигналів PI3K. Наприклад, внутрішньочерепний об'єм також асоціюється з цим шляхом, зокрема з інтронними варіантами AKT3 .[39] Гормон щитовидної залози спочатку був визначений як основний регулятор росту мозку та когнітивних функцій, і останні дані показали, що гормон щитовидної залози справляє певний вплив на дозрівання та пластичність синапсів через PI3K.[40]
Список літератури
ред.- King D, Yeomanson D, Bryant HE (May 2015). PI3King the lock: targeting the PI3K/Akt/mTOR pathway as a novel therapeutic strategy in neuroblastoma. Journal of Pediatric Hematology/Oncology. 37 (4): 245—51. doi:10.1097/MPH.0000000000000329. PMID 25811750. S2CID 42323379.
- Peltier J, O'Neill A, Schaffer DV (September 2007). PI3K/Akt and CREB regulate adult neural hippocampal progenitor proliferation and differentiation. Developmental Neurobiology. 67 (10): 1348—61. doi:10.1002/dneu.20506. PMID 17638387. S2CID 16337839.
- Rafalski VA, Brunet A (February 2011). Energy metabolism in adult neural stem cell fate. Progress in Neurobiology. 93 (2): 182—203. doi:10.1016/j.pneurobio.2010.10.007. PMID 21056618. S2CID 16305263.
- Man HY, Wang Q, Lu WY, Ju W, Ahmadian G, Liu L та ін. (May 2003). Activation of PI3-kinase is required for AMPA receptor insertion during LTP of mEPSCs in cultured hippocampal neurons. Neuron. 38 (4): 611—24. doi:10.1016/s0896-6273(03)00228-9. PMID 12765612. S2CID 17419450.
- Ojeda L, Gao J, Hooten KG, Wang E, Thonhoff JR, Dunn TJ та ін. (2011). Critical role of PI3K/Akt/GSK3β in motoneuron specification from human neural stem cells in response to FGF2 and EGF. PLOS ONE. 6 (8): e23414. Bibcode:2011PLoSO...623414O. doi:10.1371/journal.pone.0023414. PMC 3160859. PMID 21887250.
- Garcia-Galiano D, Borges BC, Allen SJ, Elias CF (2019). PI3K signalling in leptin receptor cells: Role in growth and reproduction. Journal of Neuroendocrinology. 31 (5): e12685. doi:10.1111/jne.12685. PMC 6533139. PMID 30618188.
- Wyatt LA, Filbin MT, Keirstead HS (August 2014). PTEN inhibition enhances neurite outgrowth in human embryonic stem cell-derived neuronal progenitor cells. The Journal of Comparative Neurology. 522 (12): 2741—55. doi:10.1002/cne.23580. PMID 24610700. S2CID 205683500.
- Sui L, Wang J, Li BM (October 2008). Role of the phosphoinositide 3-kinase-Akt-mammalian target of the rapamycin signaling pathway in long-term potentiation and trace fear conditioning memory in rat medial prefrontal cortex. Learning & Memory. 15 (10): 762—76. doi:10.1101/lm.1067808. PMID 18832563.
- Aziz AU, Farid S, Qin K, Wang H, Liu B (February 2018). PIM Kinases and Their Relevance to the PI3K/AKT/mTOR Pathway in the Regulation of Ovarian Cancer. Biomolecules. 8 (1): 7. doi:10.3390/biom8010007. PMC 5871976. PMID 29401696.
- Ciccone, Marcia A.; Maoz, Asaf; Casabar, Jennifer K.; Machida, Hiroko; Mabuchi, Seiji; Matsuo, Koji (July 2016). Clinical outcome of treatment with serine-threonine kinase inhibitors in recurrent epithelial ovarian cancer: a systematic review of literature. Expert Opinion on Investigational Drugs. 25 (7): 781—796. doi:10.1080/13543784.2016.1181748. ISSN 1744-7658. PMC 7534810. PMID 27101098. S2CID 28717797.
- Costa RL, Han HS, Gradishar WJ (June 2018). Targeting the PI3K/AKT/mTOR pathway in triple-negative breast cancer: a review. Breast Cancer Research and Treatment. 169 (3): 397—406. doi:10.1007/s10549-018-4697-y. PMID 29417298. S2CID 19888056.Maoz, Asaf; Ciccone, Marcia A.; Matsuzaki, Shinya; Coleman, Robert L.; Matsuo, Koji (22 листопада 2019). Emerging serine-threonine kinase inhibitors for treating ovarian cancer. Expert Opinion on Emerging Drugs. 24 (4): 239—253. doi:10.1080/14728214.2019.1696773. ISSN 1744-7623. PMC 7526049. PMID 31755325. S2CID 208227849.
- Raphael J, Desautels D, Pritchard KI, Petkova E, Shah PS (March 2018). Phosphoinositide 3-kinase inhibitors in advanced breast cancer: A systematic review and meta-analysis. European Journal of Cancer. 91: 38—46. doi:10.1016/j.ejca.2017.12.010. PMID 29331750.
- Costa RL, Han HS, Gradishar WJ (June 2018). Targeting the PI3K/AKT/mTOR pathway in triple-negative breast cancer: a review. Breast Cancer Research and Treatment. 169 (3): 397—406. doi:10.1007/s10549-018-4697-y. PMID 29417298. S2CID 19888056.
- Serra V, Markman B, Scaltriti M, Eichhorn PJ, Valero V, Guzman M та ін. (October 2008). NVP-BEZ235, a dual PI3K/mTOR inhibitor, prevents PI3K signaling and inhibits the growth of cancer cells with activating PI3K mutations. Cancer Research. 68 (19): 8022—30. doi:10.1158/0008-5472.CAN-08-1385. PMID 18829560.
- Liu ST, Hui G, Mathis C, Chamie K, Pantuck AJ, Drakaki A (April 2018). The Current Status and Future Role of the Phosphoinositide 3 Kinase/AKT Signaling Pathway in Urothelial Cancer: An Old Pathway in the New Immunotherapy Era. Clinical Genitourinary Cancer. 16 (2): e269—e276. doi:10.1016/j.clgc.2017.10.011. PMID 29199023. S2CID 4533538.
- Winkler DG, Faia KL, DiNitto JP, Ali JA, White KF, Brophy EE та ін. (November 2013). PI3K-δ and PI3K-γ inhibition by IPI-145 abrogates immune responses and suppresses activity in autoimmune and inflammatory disease models. Chemistry & Biology. 20 (11): 1364—74. doi:10.1016/j.chembiol.2013.09.017. PMID 24211136.
- Park, Soonbum; Kim, Young Sik; Kim, Davis Yeon; So, Insuk; Jeon, Ju-Hong (December 2018). PI3K pathway in prostate cancer: All resistant roads lead to PI3K. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1870 (2): 198—206. doi:10.1016/j.bbcan.2018.09.001. ISSN 1879-2561. PMID 30300679. S2CID 52947672.
- Carver, Brett S.; Chapinski, Caren; Wongvipat, John; Hieronymus, Haley; Chen, Yu; Chandarlapaty, Sarat; Arora, Vivek K.; Le, Carl; Koutcher, Jason; Scher, Howard; Scardino, Peter T. (17 травня 2011). Reciprocal feedback regulation of PI3K and androgen receptor signaling in PTEN-deficient prostate cancer. Cancer Cell. 19 (5): 575—586. doi:10.1016/j.ccr.2011.04.008. ISSN 1878-3686. PMC 3142785. PMID 21575859.
- Zahari, Muhammad Saddiq; Wu, Xinyan; Blair, Brian G.; Pinto, Sneha M.; Nirujogi, Raja S.; Jelinek, Christine A.; Malhotra, Radhika; Kim, Min-Sik; Park, Ben Ho; Pandey, Akhilesh (4 вересня 2015). Activating Mutations in PIK3CA Lead to Widespread Modulation of the Tyrosine Phosphoproteome. Journal of Proteome Research. 14 (9): 3882—3891. doi:10.1021/acs.jproteome.5b00302. ISSN 1535-3907. PMC 4641567. PMID 26267517.
- Pearson, Helen B.; Li, Jason; Meniel, Valerie S.; Fennell, Christina M.; Waring, Paul; Montgomery, Karen G.; Rebello, Richard J.; Macpherson, Arthi A.; Koushyar, Sarah; Furic, Luc; Cullinane, Carleen (June 2018). Identification of Pik3ca Mutation as a Genetic Driver of Prostate Cancer That Cooperates with Pten Loss to Accelerate Progression and Castration-Resistant Growth. Cancer Discovery. 8 (6): 764—779. doi:10.1158/2159-8290.CD-17-0867. ISSN 2159-8290. PMID 29581176.
- Agell, Laia; Hernández, Silvia; Salido, Marta; de Muga, Silvia; Juanpere, Nuria; Arumí-Uria, Montserrat; Menendez, Silvia; Lorenzo, Marta; Lorente, José A.; Serrano, Sergio; Lloreta, Josep (March 2011). PI3K signaling pathway is activated by PIK3CA mRNA overexpression and copy gain in prostate tumors, but PIK3CA, BRAF, KRAS and AKT1 mutations are infrequent events. Modern Pathology. 24 (3): 443—452. doi:10.1038/modpathol.2010.208. ISSN 1530-0285. PMID 21113138. S2CID 27405431.
- Simpson, Benjamin S.; Camacho, Niedzica; Luxton, Hayley J.; Pye, Hayley; Finn, Ron; Heavey, Susan; Pitt, Jason; Moore, Caroline M.; Whitaker, Hayley C. (14 серпня 2020). Genetic alterations in the 3q26.31-32 locus confer an aggressive prostate cancer phenotype. Communications Biology (англ.). 3 (1): 440. doi:10.1038/s42003-020-01175-x. ISSN 2399-3642. PMC 7429505. PMID 32796921. S2CID 221118233.
- Bono, Johann de; Arkenau, Hendrik-Tobias; Mateo, Joaquin; Infante, Jeffrey R.; Burris, Howard A.; Bang, Yung-Jue; Eder, Joseph; Sharma, Sunil; Chung, Hyun C.; Decordova, Shaun; Swales, Karen E. (1 серпня 2015). Abstract CT328: Exploratory genetic analysis of tumors from a phase I/II dose escalation study of GSK2636771 in patients (pts) with PTEN deficient advanced tumors. Cancer Research (англ.). 75 (15 Supplement): CT328. doi:10.1158/1538-7445.AM2015-CT328. ISSN 0008-5472.
- Greenwell IB, Ip A, Cohen JB (November 2017). PI3K Inhibitors: Understanding Toxicity Mechanisms and Management. Oncology. 31 (11): 821—8. PMID 29179250.
- duvelisib (COPIKTRA, Verastem, Inc.) for adult patients with relapsed or refractory chronic lymphocytic leukemia (CLL) or small lymphocytic lymphoma (SLL). U.S. Food and Drug Administration. Процитовано 23 жовтня 2018.
- Huck BR, Mochalkin I (July 2017). Recent progress towards clinically relevant ATP-competitive Akt inhibitors. Bioorganic & Medicinal Chemistry Letters. 27 (13): 2838—2848. doi:10.1016/j.bmcl.2017.04.090. PMID 28506751.
- Chakrabarty A, Sánchez V, Kuba MG, Rinehart C, Arteaga CL (February 2012). Feedback upregulation of HER3 (ErbB3) expression and activity attenuates antitumor effect of PI3K inhibitors. Proceedings of the National Academy of Sciences of the United States of America. 109 (8): 2718—23. Bibcode:2012PNAS..109.2718C. doi:10.1073/pnas.1018001108. PMC 3286932. PMID 21368164.
- Cappellen D, Gil Diez de Medina S, Chopin D, Thiery JP, Radvanyi F (June 1997). Frequent loss of heterozygosity on chromosome 10q in muscle-invasive transitional cell carcinomas of the bladder. Oncogene. 14 (25): 3059—66. doi:10.1038/sj.onc.1201154. PMID 9223669.
- Heavey, Susan; O'Byrne, Kenneth J.; Gately, Kathy (April 2014). Strategies for co-targeting the PI3K/AKT/mTOR pathway in NSCLC. Cancer Treatment Reviews. 40 (3): 445—456. doi:10.1016/j.ctrv.2013.08.006. ISSN 1532-1967. PMID 24055012.
- Heavey, Susan; Cuffe, Sinead; Finn, Stephen; Young, Vincent; Ryan, Ronan; Nicholson, Siobhan; Leonard, Niamh; McVeigh, Niall; Barr, Martin; O'Byrne, Kenneth; Gately, Kathy (29 листопада 2016). In pursuit of synergy: An investigation of the PI3K/mTOR/MEK co-targeted inhibition strategy in NSCLC. Oncotarget. 7 (48): 79526—79543. doi:10.18632/oncotarget.12755. ISSN 1949-2553. PMC 5346733. PMID 27765909.
- Luszczak, Sabina; Kumar, Christopher; Sathyadevan, Vignesh Krishna; Simpson, Benjamin S.; Gately, Kathy A.; Whitaker, Hayley C.; Heavey, Susan (2020). PIM kinase inhibition: co-targeted therapeutic approaches in prostate cancer. Signal Transduction and Targeted Therapy. 5: 7. doi:10.1038/s41392-020-0109-y. ISSN 2059-3635. PMC 6992635. PMID 32025342.
- Malone, Tom; Schäfer, Lea; Simon, Nathalie; Heavey, Susan; Cuffe, Sinead; Finn, Stephen; Moore, Gillian; Gately, Kathy (March 2020). Current perspectives on targeting PIM kinases to overcome mechanisms of drug resistance and immune evasion in cancer (PDF). Pharmacology & Therapeutics. 207: 107454. doi:10.1016/j.pharmthera.2019.107454. ISSN 1879-016X. PMID 31836451. S2CID 209357486.
- Heavey, Susan; Dowling, Paul; Moore, Gillian; Barr, Martin P.; Kelly, Niamh; Maher, Stephen G.; Cuffe, Sinead; Finn, Stephen P.; O'Byrne, Kenneth J.; Gately, Kathy (26 січня 2018). Development and characterisation of a panel of phosphatidylinositide 3-kinase - mammalian target of rapamycin inhibitor resistant lung cancer cell lines. Scientific Reports. 8 (1): 1652. Bibcode:2018NatSR...8.1652H. doi:10.1038/s41598-018-19688-1. ISSN 2045-2322. PMC 5786033. PMID 29374181.
- Heavey, Susan; Godwin, Peter; Baird, Anne-Marie; Barr, Martin P.; Umezawa, Kazuo; Cuffe, Sinéad; Finn, Stephen P.; O'Byrne, Kenneth J.; Gately, Kathy (October 2014). Strategic targeting of the PI3K-NFκB axis in cisplatin-resistant NSCLC. Cancer Biology & Therapy. 15 (10): 1367—1377. doi:10.4161/cbt.29841. ISSN 1555-8576. PMC 4130730. PMID 25025901.
- Schmid AC, Byrne RD, Vilar R, Woscholski R (May 2004). Bisperoxovanadium compounds are potent PTEN inhibitors. FEBS Letters. 566 (1–3): 35—8. doi:10.1016/j.febslet.2004.03.102. PMID 15147864.
- Mihai C, Bao S, Lai JP, Ghadiali SN, Knoell DL (February 2012). PTEN inhibition improves wound healing in lung epithelia through changes in cellular mechanics that enhance migration. American Journal of Physiology. Lung Cellular and Molecular Physiology. 302 (3): L287-99. doi:10.1152/ajplung.00037.2011. PMC 3289272. PMID 22037358.
- Lai JP, Dalton JT, Knoell DL (December 2007). Phosphatase and tensin homologue deleted on chromosome ten (PTEN) as a molecular target in lung epithelial wound repair. British Journal of Pharmacology. 152 (8): 1172—84. doi:10.1038/sj.bjp.0707501. PMC 2189995. PMID 17922022.
- Walker CL, Walker MJ, Liu NK, Risberg EC, Gao X, Chen J, Xu XM (2012). Systemic bisperoxovanadium activates Akt/mTOR, reduces autophagy, and enhances recovery following cervical spinal cord injury. PLOS ONE. 7 (1): e30012. Bibcode:2012PLoSO...730012W. doi:10.1371/journal.pone.0030012. PMC 3254642. PMID 22253859.
- Adams HH, Hibar DP, Chouraki V, Stein JL, Nyquist PA, Rentería ME та ін. (December 2016). Novel genetic loci underlying human intracranial volume identified through genome-wide association. Nature Neuroscience. 19 (12): 1569—1582. doi:10.1038/nn.4398. PMC 5227112. PMID 27694991.
- Martin NP, Marron Fernandez de Velasco E, Mizuno F, Scappini EL, Gloss B, Erxleben C та ін. (September 2014). A rapid cytoplasmic mechanism for PI3 kinase regulation by the nuclear thyroid hormone receptor, TRβ, and genetic evidence for its role in the maturation of mouse hippocampal synapses in vivo. Endocrinology. 155 (9): 3713—24. doi:10.1210/en.2013-2058. PMC 4138568. PMID 24932806.
- ↑ King D, Yeomanson D, Bryant HE (May 2015). PI3King the lock: targeting the PI3K/Akt/mTOR pathway as a novel therapeutic strategy in neuroblastoma. Journal of Pediatric Hematology/Oncology. 37 (4): 245—51. doi:10.1097/MPH.0000000000000329. PMID 25811750.
- ↑ а б в г д е ж и к Peltier J, O'Neill A, Schaffer DV (September 2007). PI3K/Akt and CREB regulate adult neural hippocampal progenitor proliferation and differentiation. Developmental Neurobiology. 67 (10): 1348—61. doi:10.1002/dneu.20506. PMID 17638387.
- ↑ а б в г д е ж и к л м Rafalski VA, Brunet A (February 2011). Energy metabolism in adult neural stem cell fate. Progress in Neurobiology. 93 (2): 182—203. doi:10.1016/j.pneurobio.2010.10.007. PMID 21056618.
- ↑ а б в г д Man HY, Wang Q, Lu WY, Ju W, Ahmadian G, Liu L та ін. (May 2003). Activation of PI3-kinase is required for AMPA receptor insertion during LTP of mEPSCs in cultured hippocampal neurons. Neuron. 38 (4): 611—24. doi:10.1016/s0896-6273(03)00228-9. PMID 12765612.
- ↑ а б в г д е Ojeda L, Gao J, Hooten KG, Wang E, Thonhoff JR, Dunn TJ та ін. (2011). Critical role of PI3K/Akt/GSK3β in motoneuron specification from human neural stem cells in response to FGF2 and EGF. PLOS ONE. 6 (8): e23414. Bibcode:2011PLoSO...623414O. doi:10.1371/journal.pone.0023414. PMC 3160859. PMID 21887250.
- ↑ Garcia-Galiano D, Borges BC, Allen SJ, Elias CF (2019). PI3K signalling in leptin receptor cells: Role in growth and reproduction. Journal of Neuroendocrinology. 31 (5): e12685. doi:10.1111/jne.12685. PMC 6533139. PMID 30618188.
- ↑ а б в Wyatt LA, Filbin MT, Keirstead HS (August 2014). PTEN inhibition enhances neurite outgrowth in human embryonic stem cell-derived neuronal progenitor cells. The Journal of Comparative Neurology. 522 (12): 2741—55. doi:10.1002/cne.23580. PMID 24610700.
- ↑ а б в Sui L, Wang J, Li BM (October 2008). Role of the phosphoinositide 3-kinase-Akt-mammalian target of the rapamycin signaling pathway in long-term potentiation and trace fear conditioning memory in rat medial prefrontal cortex. Learning & Memory. 15 (10): 762—76. doi:10.1101/lm.1067808. PMID 18832563.
- ↑ Aziz AU, Farid S, Qin K, Wang H, Liu B (February 2018). PIM Kinases and Their Relevance to the PI3K/AKT/mTOR Pathway in the Regulation of Ovarian Cancer. Biomolecules. 8 (1): 7. doi:10.3390/biom8010007. PMC 5871976. PMID 29401696.
- ↑ Ciccone, Marcia A.; Maoz, Asaf; Casabar, Jennifer K.; Machida, Hiroko; Mabuchi, Seiji; Matsuo, Koji (July 2016). Clinical outcome of treatment with serine-threonine kinase inhibitors in recurrent epithelial ovarian cancer: a systematic review of literature. Expert Opinion on Investigational Drugs. 25 (7): 781—796. doi:10.1080/13543784.2016.1181748. ISSN 1744-7658. PMC 7534810. PMID 27101098.
- ↑ Maoz, Asaf; Ciccone, Marcia A.; Matsuzaki, Shinya; Coleman, Robert L.; Matsuo, Koji (22 листопада 2019). Emerging serine-threonine kinase inhibitors for treating ovarian cancer. Expert Opinion on Emerging Drugs. 24 (4): 239—253. doi:10.1080/14728214.2019.1696773. ISSN 1744-7623. PMC 7526049. PMID 31755325.
- ↑ а б Raphael J, Desautels D, Pritchard KI, Petkova E, Shah PS (March 2018). Phosphoinositide 3-kinase inhibitors in advanced breast cancer: A systematic review and meta-analysis. European Journal of Cancer. 91: 38—46. doi:10.1016/j.ejca.2017.12.010. PMID 29331750.
- ↑ а б в г д Costa RL, Han HS, Gradishar WJ (June 2018). Targeting the PI3K/AKT/mTOR pathway in triple-negative breast cancer: a review. Breast Cancer Research and Treatment. 169 (3): 397—406. doi:10.1007/s10549-018-4697-y. PMID 29417298.
- ↑ Serra V, Markman B, Scaltriti M, Eichhorn PJ, Valero V, Guzman M та ін. (October 2008). NVP-BEZ235, a dual PI3K/mTOR inhibitor, prevents PI3K signaling and inhibits the growth of cancer cells with activating PI3K mutations. Cancer Research. 68 (19): 8022—30. doi:10.1158/0008-5472.CAN-08-1385. PMID 18829560.
- ↑ Liu ST, Hui G, Mathis C, Chamie K, Pantuck AJ, Drakaki A (April 2018). The Current Status and Future Role of the Phosphoinositide 3 Kinase/AKT Signaling Pathway in Urothelial Cancer: An Old Pathway in the New Immunotherapy Era. Clinical Genitourinary Cancer. 16 (2): e269—e276. doi:10.1016/j.clgc.2017.10.011. PMID 29199023.
- ↑ Winkler DG, Faia KL, DiNitto JP, Ali JA, White KF, Brophy EE та ін. (November 2013). PI3K-δ and PI3K-γ inhibition by IPI-145 abrogates immune responses and suppresses activity in autoimmune and inflammatory disease models. Chemistry & Biology. 20 (11): 1364—74. doi:10.1016/j.chembiol.2013.09.017. PMID 24211136.
- ↑ Park, Soonbum; Kim, Young Sik; Kim, Davis Yeon; So, Insuk; Jeon, Ju-Hong (December 2018). PI3K pathway in prostate cancer: All resistant roads lead to PI3K. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1870 (2): 198—206. doi:10.1016/j.bbcan.2018.09.001. ISSN 1879-2561. PMID 30300679.
- ↑ Carver, Brett S.; Chapinski, Caren; Wongvipat, John; Hieronymus, Haley; Chen, Yu; Chandarlapaty, Sarat; Arora, Vivek K.; Le, Carl; Koutcher, Jason (17 травня 2011). Reciprocal feedback regulation of PI3K and androgen receptor signaling in PTEN-deficient prostate cancer. Cancer Cell. 19 (5): 575—586. doi:10.1016/j.ccr.2011.04.008. ISSN 1878-3686. PMC 3142785. PMID 21575859.
- ↑ Zahari, Muhammad Saddiq; Wu, Xinyan; Blair, Brian G.; Pinto, Sneha M.; Nirujogi, Raja S.; Jelinek, Christine A.; Malhotra, Radhika; Kim, Min-Sik; Park, Ben Ho (4 вересня 2015). Activating Mutations in PIK3CA Lead to Widespread Modulation of the Tyrosine Phosphoproteome. Journal of Proteome Research. 14 (9): 3882—3891. doi:10.1021/acs.jproteome.5b00302. ISSN 1535-3907. PMC 4641567. PMID 26267517.
- ↑ Pearson, Helen B.; Li, Jason; Meniel, Valerie S.; Fennell, Christina M.; Waring, Paul; Montgomery, Karen G.; Rebello, Richard J.; Macpherson, Arthi A.; Koushyar, Sarah (June 2018). Identification of Pik3ca Mutation as a Genetic Driver of Prostate Cancer That Cooperates with Pten Loss to Accelerate Progression and Castration-Resistant Growth. Cancer Discovery. 8 (6): 764—779. doi:10.1158/2159-8290.CD-17-0867. ISSN 2159-8290. PMID 29581176.
- ↑ Agell, Laia; Hernández, Silvia; Salido, Marta; de Muga, Silvia; Juanpere, Nuria; Arumí-Uria, Montserrat; Menendez, Silvia; Lorenzo, Marta; Lorente, José A. (March 2011). PI3K signaling pathway is activated by PIK3CA mRNA overexpression and copy gain in prostate tumors, but PIK3CA, BRAF, KRAS and AKT1 mutations are infrequent events. Modern Pathology. 24 (3): 443—452. doi:10.1038/modpathol.2010.208. ISSN 1530-0285. PMID 21113138.
- ↑ а б Simpson, Benjamin S.; Camacho, Niedzica; Luxton, Hayley J.; Pye, Hayley; Finn, Ron; Heavey, Susan; Pitt, Jason; Moore, Caroline M.; Whitaker, Hayley C. (14 серпня 2020). Genetic alterations in the 3q26.31-32 locus confer an aggressive prostate cancer phenotype. Communications Biology (англ.). 3 (1): 440. doi:10.1038/s42003-020-01175-x. ISSN 2399-3642. PMC 7429505. PMID 32796921.
- ↑ Bono, Johann de; Arkenau, Hendrik-Tobias; Mateo, Joaquin; Infante, Jeffrey R.; Burris, Howard A.; Bang, Yung-Jue; Eder, Joseph; Sharma, Sunil; Chung, Hyun C. (1 серпня 2015). Abstract CT328: Exploratory genetic analysis of tumors from a phase I/II dose escalation study of GSK2636771 in patients (pts) with PTEN deficient advanced tumors. Cancer Research (англ.). 75 (15 Supplement): CT328. doi:10.1158/1538-7445.AM2015-CT328. ISSN 0008-5472.
- ↑ Greenwell IB, Ip A, Cohen JB (November 2017). PI3K Inhibitors: Understanding Toxicity Mechanisms and Management. Oncology. 31 (11): 821—8. PMID 29179250.
- ↑ duvelisib (COPIKTRA, Verastem, Inc.) for adult patients with relapsed or refractory chronic lymphocytic leukemia (CLL) or small lymphocytic lymphoma (SLL). U.S. Food and Drug Administration. Процитовано 23 жовтня 2018.
- ↑ а б Huck BR, Mochalkin I (July 2017). Recent progress towards clinically relevant ATP-competitive Akt inhibitors. Bioorganic & Medicinal Chemistry Letters. 27 (13): 2838—2848. doi:10.1016/j.bmcl.2017.04.090. PMID 28506751.
- ↑ Chakrabarty A, Sánchez V, Kuba MG, Rinehart C, Arteaga CL (February 2012). Feedback upregulation of HER3 (ErbB3) expression and activity attenuates antitumor effect of PI3K inhibitors. Proceedings of the National Academy of Sciences of the United States of America. 109 (8): 2718—23. Bibcode:2012PNAS..109.2718C. doi:10.1073/pnas.1018001108. PMC 3286932. PMID 21368164.
- ↑ Cappellen D, Gil Diez de Medina S, Chopin D, Thiery JP, Radvanyi F (June 1997). Frequent loss of heterozygosity on chromosome 10q in muscle-invasive transitional cell carcinomas of the bladder. Oncogene. 14 (25): 3059—66. doi:10.1038/sj.onc.1201154. PMID 9223669.
- ↑ Heavey, Susan; O'Byrne, Kenneth J.; Gately, Kathy (April 2014). Strategies for co-targeting the PI3K/AKT/mTOR pathway in NSCLC. Cancer Treatment Reviews. 40 (3): 445—456. doi:10.1016/j.ctrv.2013.08.006. ISSN 1532-1967. PMID 24055012.
- ↑ Heavey, Susan; Cuffe, Sinead; Finn, Stephen; Young, Vincent; Ryan, Ronan; Nicholson, Siobhan; Leonard, Niamh; McVeigh, Niall; Barr, Martin (29 листопада 2016). In pursuit of synergy: An investigation of the PI3K/mTOR/MEK co-targeted inhibition strategy in NSCLC. Oncotarget. 7 (48): 79526—79543. doi:10.18632/oncotarget.12755. ISSN 1949-2553. PMC 5346733. PMID 27765909.
- ↑ Luszczak, Sabina; Kumar, Christopher; Sathyadevan, Vignesh Krishna; Simpson, Benjamin S.; Gately, Kathy A.; Whitaker, Hayley C.; Heavey, Susan (2020). PIM kinase inhibition: co-targeted therapeutic approaches in prostate cancer. Signal Transduction and Targeted Therapy. 5: 7. doi:10.1038/s41392-020-0109-y. ISSN 2059-3635. PMC 6992635. PMID 32025342.
- ↑ Malone, Tom; Schäfer, Lea; Simon, Nathalie; Heavey, Susan; Cuffe, Sinead; Finn, Stephen; Moore, Gillian; Gately, Kathy (March 2020). Current perspectives on targeting PIM kinases to overcome mechanisms of drug resistance and immune evasion in cancer (PDF). Pharmacology & Therapeutics. 207: 107454. doi:10.1016/j.pharmthera.2019.107454. ISSN 1879-016X. PMID 31836451.
- ↑ Heavey, Susan; Dowling, Paul; Moore, Gillian; Barr, Martin P.; Kelly, Niamh; Maher, Stephen G.; Cuffe, Sinead; Finn, Stephen P.; O'Byrne, Kenneth J. (26 січня 2018). Development and characterisation of a panel of phosphatidylinositide 3-kinase - mammalian target of rapamycin inhibitor resistant lung cancer cell lines. Scientific Reports. 8 (1): 1652. Bibcode:2018NatSR...8.1652H. doi:10.1038/s41598-018-19688-1. ISSN 2045-2322. PMC 5786033. PMID 29374181.
- ↑ Heavey, Susan; Godwin, Peter; Baird, Anne-Marie; Barr, Martin P.; Umezawa, Kazuo; Cuffe, Sinéad; Finn, Stephen P.; O'Byrne, Kenneth J.; Gately, Kathy (October 2014). Strategic targeting of the PI3K-NFκB axis in cisplatin-resistant NSCLC. Cancer Biology & Therapy. 15 (10): 1367—1377. doi:10.4161/cbt.29841. ISSN 1555-8576. PMC 4130730. PMID 25025901.
- ↑ Schmid AC, Byrne RD, Vilar R, Woscholski R (May 2004). Bisperoxovanadium compounds are potent PTEN inhibitors. FEBS Letters. 566 (1–3): 35—8. doi:10.1016/j.febslet.2004.03.102. PMID 15147864.
- ↑ Mihai C, Bao S, Lai JP, Ghadiali SN, Knoell DL (February 2012). PTEN inhibition improves wound healing in lung epithelia through changes in cellular mechanics that enhance migration. American Journal of Physiology. Lung Cellular and Molecular Physiology. 302 (3): L287-99. doi:10.1152/ajplung.00037.2011. PMC 3289272. PMID 22037358.
- ↑ Lai JP, Dalton JT, Knoell DL (December 2007). Phosphatase and tensin homologue deleted on chromosome ten (PTEN) as a molecular target in lung epithelial wound repair. British Journal of Pharmacology. 152 (8): 1172—84. doi:10.1038/sj.bjp.0707501. PMC 2189995. PMID 17922022.
- ↑ Walker CL, Walker MJ, Liu NK, Risberg EC, Gao X, Chen J, Xu XM (2012). Systemic bisperoxovanadium activates Akt/mTOR, reduces autophagy, and enhances recovery following cervical spinal cord injury. PLOS ONE. 7 (1): e30012. Bibcode:2012PLoSO...730012W. doi:10.1371/journal.pone.0030012. PMC 3254642. PMID 22253859.
- ↑ Adams HH, Hibar DP, Chouraki V, Stein JL, Nyquist PA, Rentería ME та ін. (December 2016). Novel genetic loci underlying human intracranial volume identified through genome-wide association. Nature Neuroscience. 19 (12): 1569—1582. doi:10.1038/nn.4398. PMC 5227112. PMID 27694991.
- ↑ Martin NP, Marron Fernandez de Velasco E, Mizuno F, Scappini EL, Gloss B, Erxleben C та ін. (September 2014). A rapid cytoplasmic mechanism for PI3 kinase regulation by the nuclear thyroid hormone receptor, TRβ, and genetic evidence for its role in the maturation of mouse hippocampal synapses in vivo. Endocrinology. 155 (9): 3713—24. doi:10.1210/en.2013-2058. PMC 4138568. PMID 24932806.