Дихлорометан
Дихлорометан (хлористий метилен, ДХМ, CH2Cl2) — прозора легкорухома і легколетка рідина з характерним для галогенпохідних солодкуватим запахом. Вперше був синтезований 1840 року витримуванням суміші хлору з хлористим метилом на світлі. В цілому найбезпечніший серед галогеноалканів.
| Структурна формула | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 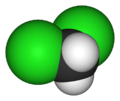
| |||||||||||||||||||||||||
| Загальна інформація | |||||||||||||||||||||||||
| Преференційна назва ІЮПАК | Дихлорометан | ||||||||||||||||||||||||
| Систематична назва ІЮПАК | Дихлорометан | ||||||||||||||||||||||||
| Інші назви |
| ||||||||||||||||||||||||
| Хімічна формула | CH2Cl2 | ||||||||||||||||||||||||
| 3D Структура (JSmol) | Інтерактивне зображення
| ||||||||||||||||||||||||
| Зовнішні ідентифікатори / Бази даних | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Властивості | |||||||||||||||||||||||||
| Молярна маса | 84.93 г·моль-1 | ||||||||||||||||||||||||
| Агрегатний стан |
Рідина | ||||||||||||||||||||||||
| Густина |
1.33 г·см-3 (20 °C)[1] | ||||||||||||||||||||||||
| Температура плавлення |
-97 °C[1] | ||||||||||||||||||||||||
| Температура кипіння |
40 °C[1] | ||||||||||||||||||||||||
| Тиск насиченої пари |
| ||||||||||||||||||||||||
| Розчинність |
| ||||||||||||||||||||||||
| Дипольний момент | |||||||||||||||||||||||||
| Коефіцієнт заломлення |
1.4242 (20 °C)[2] | ||||||||||||||||||||||||
| Термодинамічні властивості | |||||||||||||||||||||||||
| ΔfH⦵298 |
-124.2 кДж·моль-1[2] | ||||||||||||||||||||||||
| Безпека | |||||||||||||||||||||||||
| Маркування згідно системі УГС
Увага | |||||||||||||||||||||||||
| H-фрази | H: H315, H319, H335, H336, H351, H373 | ||||||||||||||||||||||||
| P-фрази | P: P261, P305+P351+P338 | ||||||||||||||||||||||||
| LD50 |
1600 мг/кг (орально, пацюк)[1] | ||||||||||||||||||||||||
| Наскільки це можливо, значення величин подані в одиницях системи SI. Якщо не вказано іншого, усі дані відносяться до стандартного стану. | |||||||||||||||||||||||||
Отримання
ред.Отримують прямим хлоруванням метану хлором в умовах радикального механізму при 400—500 °C при співвідношенні рівному 5:1
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
У результаті виходить суміш всіх можливих хлоридів: хлорометан, діхлорометан, хлороформ та чотирихлористий вуглець, які потім розділяються дистиляцією. Після чого він має чистоту не менше 99,7 %.
Фізичні властивості
ред.Розчинність у воді 2 % за масою (13 г/л), змішується з більшістю органічних розчинників. Легколеткий (39,7 °C), утворює азеотропну суміш з водою (Ткип 38,1 °C, 98,5 % діхлорометану).
Хімічні властивості
ред.Метиленхлорид (діхлорометан) реагує з хлором з поетапним утворенням хлороформу і чотирихлористого вуглецю.
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
З йодом при 200 °C дає СН2l2, з бромом при 25-30 °C у присутності алюмінію — бромхлорметан.
При нагріванні з водою гідролізується до метаналю:
- CH2Cl2 + H2O → HCOH + HCl
При нагріванні зі спиртовим розчином амоніаку NH3 до 100-125 °C утворює гексаметилентетрамін.
Реакція з водним розчином NH3 при 200 °C приводить до утворення метиламіну, мурашиної кислоти і HCl.
З ароматичними сполуками в присутності AlCl3 метиленхлорид вступає в реакцію Фріделя — Крафтса, наприклад з бензеном утворюється дифенілметан.
Див. також
ред.Джерела
ред.- Химическая энциклопедия. Т. 3. — М. : 1988. — C. 60—61
Примітки
ред.- ↑ а б в г д е Внесок про дихлорометан [Архівовано 2017-06-20 у Wayback Machine.] в базі даних GESTIS
- ↑ а б в г W. M. Haynes, CRC Handbook of Chemistry and Physics, 97th Edition, CRC Press, 2016-2017
| Це незавершена стаття про органічну сполуку. Ви можете допомогти проєкту, виправивши або дописавши її. |

