Ціанід кальцію
Ціанід кальцію — неорганічна сполука з формулою Ca(CN)2. Це сіль кальцію, отримана з синильної кислоти. Це біла тверда речовина, хоча в чистому вигляді вона зустрічається рідко. Вона легко гідролізується (навіть у вологому повітрі) з виділенням ціаніду водню і дуже токсичний.
| Ціанід кальцію | |
|---|---|
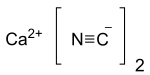
| |
| Назва за IUPAC | calcium dicyanide |
| Систематична назва | calcium dicyanide |
| Ідентифікатори | |
| Номер CAS | 592-01-8 |
| PubChem | 11590 |
| Номер EINECS | 209-740-0 |
| SMILES | [Ca+2].[C-]#N.[C-]#N |
| InChI | InChI=1S/2CN.Ca/c2*1-2;/q2*-1;+2 |
| Властивості | |
| Молекулярна формула | Ca(CN)2 |
| Молярна маса | 92.1128 г/моль |
| Зовнішній вигляд | білий порошок |
| Густина | 1.853 (20 °C) |
| Тпл | 640 |
| Структура | |
| Кристалічна структура | ромбоедрична |
| Небезпеки | |
| ЛД50 | 39 mg/kg rat, oral[1] |
| Головні небезпеки | високотоксичний |
| NFPA 704 | |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Підготовка ред.
Розчини ціаніду кальцію можна приготувати обробкою гідроксиду кальцію ціаністим воднем. Твердий ціанід кальцію промислово виробляють шляхом нагрівання ціанаміду кальцію з хлоридом натрію. Реакція неповна. Продукт має лише 50 % чистоти, іншими компонентами є ціанід натрію, ціанамід кальцію та вуглець. Через домішки вуглецю тверда речовина чорна, тому матеріал часто називають чорним ціанідом.
Реактивність ред.
При температурах близько 600 °C ціанід кальцію перетворюється на ціанамід кальцію[3][4]:
- Ca(CN)2 → CaCN2 + C
Є припущення, що ця реакція є одним із етапів перетворення карбіду кальцію газоподібним азотом. Частка ціаніду кальцію відносно ціанаміду кальцію чутлива до присутності галогенідів лужних металів, таких як хлорид натрію.
Ціанід кальцію гідролізується при підкисленні з утворенням ціаніду водню:
- Ca(CN)2 + 2 H+ → Ca2+ + 2 HCN
Ціанід кальцію реагує з карбонатом амонію[en], утворюючи ціанід амонію[en]:
- Ca(CN)2 + (NH4)2CO3 → 2 NH4CN + CaCO3
Використання ред.
Ціанід кальцію використовується майже виключно в гірничодобувній промисловості. Він служить недорогим джерелом ціаніду в багатьох операціях вилуговування для виділення дорогоцінних металів, таких як золото та срібло, з їхніх руд[5].
Безпека ред.
Як і інші ціанідні солі, ціанід кальцію високотоксичний, і його використання суворо регламентоване.
Примітки ред.
- ↑ GESTIS-Stoffdatenbank. gestis-dguv-de. Процитовано 16 квітня 2022.
- ↑ CALCIUM CYANIDE | CAMEO Chemicals | NOAA.
- ↑ «Production of Hydrocyanic Acid» United States Patent Office.
- ↑ Thomas Güthner; Bernd Mertschenk (2006). Cyanamides. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a08_139.pub2. ISBN 3527306730.
- ↑ «Use of Cyanide for the Gold Industry» International Cyanide Management Code for the Use of Cyanide in the Gold .
