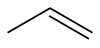
Пропілен
Пропіле́н, пропе́н — органічна сполука, ненасичений вуглеводень ряду алкенів складу СН2=СНСН3. За стандартних умов є безбарвним газом зі слабким запахом.
| Пропілен | |
|---|---|
Скелетна формула пропілену
|
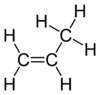 |
 |
 Пропілен
|
| Назва за IUPAC | Пропен |
| Ідентифікатори | |
| Номер CAS | 115-07-1 |
| PubChem | 8252 |
| Номер EINECS | 204-062-1 |
| KEGG | C11505 |
| ChEBI | CHEBI:16052 |
| RTECS | UC6740000 |
| SMILES | CC=C |
| InChI | 1/C3H6/c1-3-2/h3H,1H2,2H3 |
| Номер Бельштейна | 1696878 |
| Номер Гмеліна | 852 |
| Властивості | |
| Молекулярна формула | С3Н6 |
| Молярна маса | 42,08 г/моль |
| Молекулярна маса | 42 а. о. м. |
| Зовнішній вигляд | безбарвний газ |
| Запах | слабкий |
| Густина | 1,81 кг/м³ (1,013 бар 15 °C) |
| Тпл | − 185,2 °C |
| Ткип | − 47,6 °C |
| Розчинність (вода) | 44,6 мг/100мл при 20 °C і 1 кгс/см² |
| Розчинність (етанол) | 1250 мл/100 мл |
| Розчинність (оцтова кислота) | 524,5 мл/100 мл |
| Тиск насиченої пари | 1500 мм рт.ст. (при – 31,55 °C) |
| В'язкість | 0,37 сП (при -100 °C) |
| Структура | |
| Дипольний момент | 0,336 |
| Термохімія | |
| Ст. ентальпія утворення ΔfH 298 |
4,879 ккал/моль |
| Ст. ентальпія згоряння ΔcH 298 |
460,42 ккал/моль |
| Ст. ентропія S 298 |
63,80 кал/(моль·°C) |
| Теплоємність, c p |
15,27 кал/(моль·C) |
| Небезпеки | |
| ГДК (Україна) | 100 мг/м³ |
| NFPA 704 | |
| Температура спалаху | - 108 °C |
| Температура самозаймання | не нижче 410 °C |
| Вибухові границі | 2,3—11,1 % |
| Пов'язані речовини | |
| Інші | аліл, пропеніл |
| Пов'язані речовини | пропан, пропін, пропадієн, пропіловий спирт, ізопропіловий спирт |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Пропілен у значних кількостях міститься в продуктах крекінгу і піролізу нафтопродуктів, у невеликих концентраціях в коксових газах. В атмосферу потрапляє як від природних джерел (деякі види рослин, зокрема дерев), так і від антропогенних (пожежі, вихлопні гази автомобілів і літаків, тютюновий дим)[1].
Окислюється деякими видами бактерій, зокрема бактеріями, які окислюють метан. Через невеликий час перебування в атмосфері, і, як правило, низьку концентрацію в довкіллі, його внесок у процес глобального потепління вважається незначним.
Пропілен є важливою сировиною нафтохімічної промисловості. Використовується при виробництві пластмас, каучуків, масел, присадок і мийних засобів (три- і тетрамери), високооктанових компонентів моторних палив, розчинників. Він також є інгібітором при газофазному дехлоруванні хлоро- і поліхлороалканів.
У 2002 році в Азії було вироблено близько 22 мільйонів тонн пропілену, 17 мільйонів тонн — в Західній Європі і 21 мільйон тонн — в Північній Америці[2]. У торговий пропілен додають невелику кількість домішок (зазвичай меркаптанів) для надання характерного запаху. Це дає можливість виявити навіть незначні витоки газу.
Зазвичай транспортується і зберігається в рідкому вигляді під тиском, оскільки в такому стані займає набагато менший об'єм (1 частина рідини дає 250 частин газу). Дуже слабко розчинний у воді, проте легко розчинний у спирті.
Історія ред.
У 1795 році шляхом відщеплення води від етанолу за допомогою концентрованої сірчаної кислоти був одержаний етилен[3], який став першою сполукою ряду олефінів. Завдяки здатності утворювати з хлором рідкий продукт, він отримав назву «масло голландських хіміків»[4]. Від етилену згодом було утворене найменування всього ряду простих ненасичених аліфатичних вуглеводнів.
Лише через 50 років Рейнольдс виділив черговий гомолог цього ряду — пропілен[5]. Він добув його при пропусканні сивушного масла через розжарені трубки. Незважаючи на те, що для отримання пропілену були розроблені спеціальні методи, зокрема з пропілового та ізопропілового спирту, ще кілька наступних десятиліть пропілен залишався лише лабораторним продуктом і промислових процесів отримання пропілену не існувало.
Фізичні властивості ред.
Молекула пропілену складається з двох атомів вуглецю, зв'язаних подвійним зв'язком, трьох атомів водню та однієї метильної групи. Всі ці шість складових лежать в одній спільній площині. Кут між зв'язками Н—С—Н становить 119°, що є дуже близьким значенням до 120° — ідеальної умови sp2-гібридизації. Обертання С=С зв'язку вимагає витрати відносно великої кількості енергії, оскільки при цьому необхідний розрив пі-зв'язку.
При кімнатній температурі та атмосферному тиску, пропілен є газом. Як і багато інших алкенів він є безбарвним зі слабким, проте неприємним, запахом.
Завдяки більшій масі пропілен володіє вищою в'язкістю і температурою кипіння ніж етилен. Він є більш леткою речовиною, ніж пропан. Через меншу симетрію молекула пропілену має невеликий дипольний момент.
Отримання ред.
Процесів, кінцевим бажаним продуктом яких був би пропілен, не існує. Однак в промисловості він є широко поширеним побічним та супутнім продуктом. Він утворюється майже при всіх методах піролізу для одержання етилену. Також у великих кількостях пропілен виробляється при розділенні газової суміші, що утворюється на нафтопереробних заводах при крекінгу і риформінгу.
Виділення з нафтозаводських і крекінг-газів ред.
При чисто фізичній перегонці нафти і природного газу олефіни відсутні. На сучасних нафтопереробних заводах олефіновмісні абгази утворюються при виробництві високоякісного бензину шляхом риформінг- і крекінг-процесів. Гази термічного і каталітичного крекінгу мають різний склад у залежності від методу роботи установок.
Зазвичай вихід газу становить 4,5–5,5 % мас. від загальної кількості сирої нафти, що надходить на нафтопереробний завод. Газова суміш, що утворюється на нафтопереробному заводі, як правило, містить близько 8,9 % мол. пропілену[6].
Нафтозаводський газ стискують, охолоджуючи при цьому після кожного ступеня стиснення. Кислі гази, в основному H2S і СО2, абсорбують етаноламіном і потім газ промивають лугом. Після охолодження і подальшої компресії проводять зневоднення (раніше за допомогою Al2О3, тепер на молекулярних ситах).
Методом низькотемпературного фракціонування суміш розділяють на етан, етилен, пропан, пропілен і паливний газ. Етан і пропан піддають подальшому крекінгу в трубчатих печах у присутності водяної пари для отримання етилену і пропілену. Після компресії і охолодження гази знову направляють на установку для їх розділення. Ацетилен видаляється шляхом каталітичного гідрування із загальної кількості нафтозаводського газу, або тільки з етиленових фракцій. Поділ пропану і пропілену здійснюється дистиляцією або, якщо це доцільно, проведенням з сумішшю ряду реакцій[7].
Синтез за методом Фішера — Тропша ред.
При синтезі Фішера — Тропша як побічний продукт утворюється пропілен. Його кількість залежить від каталізатору та умов реакції. При нормальному тиску і температурі реакції 175–210 °С на кобальтових каталізаторах фракція С3—С4 містить до 43 % олефінів[8]. Аналогічний вміст олефінів спостерігається при 100 °С і середньому тиску 10 кгс/см².
При циркуляційному режимі роботи, коли час перебування сировини в реакторі значно нижчий, вміст олефінів збільшується до 65 %[9]. Використання залізних каталізаторів сприяє подальшому підвищенню вмісту олефінів. Присутність залізного порошку, суспендованого в маслі, через яке пропускають синтез-газ, призводить до утворення у фракції С3-С4 75 80 % олефінів при 250 °С і тиску 20 кгс/см², з них частка пропілену становить 8,9 % мас.
Виділення із напівкоксового та коксового газів ред.
При напівкоксуванні кам'яного вугілля при 500–600 °С утворюється приблизно 10% газу, що містить 1–8 % пропілену. При коксуванні при 1000 °С виходить 25 % газу, але пропілену в ньому тільки 0,36 %[10]. Після виділення з коксового газу водню в зрідженому газі, що залишився (рур-газоль), вміст олефінових фракції С3—С4 доходить до 54 %, і він може служити джерелом одержання пропілену.
Отримання із сполук С3 ред.
Термічне дегідрування пропану ред.
У промисловому масштабі здійснюється тільки термічне дегідрування етану та ізобутану, в результаті якого отримують відповідно етилен та ізобутилену.
При короткочасному нагріванні пропану до високих температур утворюється лише невелика кількість пропілену, так як реакції крекінгу
- — 16,1 ккал/моль
протікають краще, ніж реакція дегідрування:
- — 30,0 ккал/моль
Вирішальну роль при термічному крекінгу пропану відіграє перша реакція.
Утворення великої кількості етилену пояснюється тим, що для розриву зв'язку С-С потрібно значно менше енергії (62,5 ккал/моль)[11], ніж для розриву зв'язку С-Н (87 ккал/моль для первинного зв'язку, 85,8 ккал/моль для вторинного і 83 ккал/моль для третинного). Реакція дегідрування є рівноважною, при підвищенні температури рівновага зсувається вправо.
При промислових масштабах проведення термічного дегідрування (крекінгу) пропану в етилен вихід пропілену можна підвищити шляхом зміни умов реакції до співвідношення етилен:пропілен 1:1.
Каталітичне дегідрування пропану ред.
При отриманні пропілену шляхом дегідрування пропану необхідне застосування спеціальних каталізаторів для того, щоб в якомога коротший термін подолати порівняно високу енергію зв'язку С—Н (87,3 ккал/моль). Ефективний каталізатор суттєво прискорює процес дегідрування. При цьому кількість небажаних побічних продуктів стає незначною, так як побічні реакції протікають повільніше.
При некаталітичному процесі високу енергію зв'язку С—Н можна подолати, збільшивши час контакту при високих температурах. Проте цей спосіб веде до прискорення реакцій розкладу.
Для каталітичного дегідрування пропану застосовуються каталізатори: Cr2О3, МоО3, V2О5, ТіО2 і СеО2[12]. З них найкраще себе зарекомендував Cr2О3, який використовується для зменшення рекристалізації на носії γ-Al2О3. В промисловості працює при температурах, що перевищують 500 °С.
Процес дегідрування без побічних реакцій можливий лише при низьких значеннях конверсії і короткому часі перебування пропану на каталізаторі.
Протікання реакції
- — 30,0 ккал/моль
супроводжується збільшенням об'єму, що свідчить про закінчення процесу дегідрування. Тому зниження тиску сприяє утворенню пропілену при дегідруванні, яке закінчується реакцією рівноваги.
При проведенні процесу каталітичного дегідрування рекомендується застосування каталізатора наступного складу: 93,5 % Al2О3, 5 % Cr2О3 і 1,5 % К2О. За умови роботи в кварцовому реакторі та об'ємній продуктивності каталізатора 300 л/год (у перерахунку на пропан) оптимальна температура реакції складатиме 610–660 °С, а при роботі в металічному реакторі і об'ємній продуктивності каталізатора 400–700 л/год оптимальна температура буде 570–600 °С[13].
Каталізатор з Сг2О3 при 575 °С дає 95 % пропілену, при цьому вихід залишається постійним у широкому діапазоні, однак конверсія становить тільки 25,8 %[14].
Отримання пропілену з інших газоподібних вуглеводнів ред.
Отримання з етилену і етану ред.
При нагріванні етилену в присутності кисню до 377–600 °С поряд з іншими сполуками (в основному С4) отримують пропілен[15].
Пропілен утворюється також при нагріванні етану до 800–880 °С в основному в результаті взаємодії бутилену, що утворюється раніше, з етиленом[16]. Максимальний вихід (91 %) отримують в атмосфері кисню, при часі контакту 3 с і температурі реакції 490 °С[17].
Отримання з бутану та ізобутану ред.
При промисловому піролізі бутану відбувається його розщеплення на етилен і етан, а також на пропілен і метан. Дегідрування до бутилену або бутадієну відбувається в набагато меншому масштабі у порівнянні з утворенням пропілену.
В отриманій при піролізі бутану фракції С3 майже відсутній пропан. Це є великою перевагою, так як відпадає необхідність у розділенні пропану та пропілену і можна отримувати дуже чистий пропілен.
Хімічні властивості ред.
Оксосинтез пропілену ред.
При оксосинтезі (реакції Релена, гідроформілюванні) оксид вуглецю і водень приєднуються за подвійними зв'язками, утворюючи альдегіди або спирти:
Реакція, яка відома тепер у всьому світі під назвою оксосинтез, була відкрита в 1938 році Реленом[18]. На перших промислових установках алкени з довгими ланцюгами С11—С17 перетворювали в альдегіди, а потім в спирти з метою отримання сировини для синтетичних миючих засобів. Нижчі олефіни (такі, як етилен і пропілен) почали застосовувати для оксосинтезу в промисловому масштабі лише після 1945 року. Зараз у багатьох країнах працюють промислові установки, де застосовується процес оксосинтезу пропілену[19].
Спочатку для оксосинтезу використовували гетерогенні каталізатори кобальту, що застосовуються також при синтезі за методом Фішера — Тропша. Пізніше перейшли на розчинні в реакційному середовищі каталізатори кобальту (нафтенат, олеат, стеарат, сульфат)[20][21]. Найбільш ефективними каталізаторами оксосинтезу, ймовірно, є Со2(СО)8 і НСо(СО)4, які легко утворюються при впливі на кобальт оксиду вуглецю і водню під тиском при підвищених температурах. Механізм реакції оксосинтезу тлумачиться по-різному, однак в загальному його можна представити наступним чином:
Оксосинтез перетворився на один з найважливіших процесів нафтохімічної промисловості. Це, в першу чергу, пояснюється широкими можливостями процесу. Практично всі олефіни чи олефіновмісна сировина може взаємодіяти з оксидом вуглецю і воднем. Завдяки цьому в промисловості виробляють цілий ряд альдегідів і спиртів С3—С20. Продуктом реакції, при використанні як сировини високочистого олефіну, є складна суміш, оскільки, з одного боку, одночасно утворюється завжди кілька ізомерних альдегідів і спиртів, а з іншого боку, постійно протікають побічні реакції. Тому велике значення надається підбору потрібних умов реакції для зменшення небажаних побічних реакцій.
Оксосинтез вигідно відрізняється від інших синтезів спиртів тим, що умови процесу можна варіювати без великих змін апаратури.
Зараз відомо кілька варіантів процесу оксосинтезу, які відрізняються один від одного в основному способом виробництва і відновлення каталізатора. Найбільш поширеними методами є:
- метод з нерухомим каталізатором;
- суспензійний метод;
- сольовий метод (каталізатор — нафтенат кобальту).
Альдокс-процес ред.
Модифікувавши оксосинтез, можна отримувати з низькомолекулярних олефінів високомолекулярні спирти[22][23][24][25]. В даному випадку проміжні альдегіди, які утворюються при оксосинтезі, перетворюються на вищі спирти шляхом ди-, тримеризації і т. д. Для цього методу застосовується звичайний для оксосинтезу кобальтовий каталізатор. У випадку димеризації додають невелику кількість цинковмісних сполук.
Вдосконалений процес оксосинтезу, розроблений американською фірмою «Esso Research and Engineering Co.», отримав назву альдокс-процесу.
Хлорування (галогенування) пропілену ред.
У залежності від реакційних умов процес хлорування (чи в загальному галогенування) пропілену дає різні кінцеві продукти.
Хлорування при низьких температурах (до 250 °С) веде переважно до приєднання хлору за подвійним зв'язком, як це зазвичай відбувається у випадку алкенів з прямими ланцюгами:
Гаряче хлорування (при 500–550 °С) дає головним чином заміщені продукти, наприклад алілхлорид:
Перхлорування пропілену при 450–550 °С веде до приєднання хлору і заміщення, а також до відщеплення хлорованої молекули. У залежності від умов хлорування з суміші пропан-пропілен утворюються перхлоретилен і чотирихлористий вуглець (процес Progil-Electrochimie Solvay, Франція)[26]:
Димеризація ред.
У загальному процес димеризації пропілену підсумовується наступним рівнянням реакції:
Для димеризації пропілену пропонуються в основному дві групи каталізаторів[27]:
- алюмінійорганічні сполуки (каталізатори Ціглера-Натта);
- лужні метали (або сполуки, з яких легко утворюються лужні метали) на різних носіях.
У промисловості найбільше поширення отримали сполуки першої групи, особливо трипропілалюміній. При проведенні процесу димеризації слід враховувати наступне:
- для досягнення високої селективності потрібно застосовувати каталізатор при низькій концентрації, час контакту повинен бути коротким;
- реакцію з трипропілалюмінієм слід проводити при 200 °С під тиском нижче 90 кгс/см² в двофазній, а потім в однофазній системі;
- перенесення речовини визначає швидкість реакції;
- в двофазній системі димеризація відбувається в рідкій фазі, а пропілен знаходиться переважно в газовій фазі;
- при більш тривалому часі контакту конверсія збільшується, однак падає селективність;
- з підвищенням температури загальна конверсія підвищується, але знижується селективність внаслідок ізомеризації і тримеризації.
Дослідження застосування лужних металів як каталізаторів процесу димеризації пропілену показали, що сполуки лужний метал-графіт, які мають пластинчасту структуру, є відмінними каталізаторами[28][29][30]. Різні типи цих сполук поводяться по-різному, але найбільш придатний до використання з них NaC64. Реакція за його участю триває кілька хвилин при температурах вище 200 °С. Продуктами є переважно тримери і тетрамери, димерів утворюється менше.
Самі лужні метали так само, як їхні гідриди, мають високу активність і тому часто пропонуються як каталізатори, причому на дуже різних носіях. Димеризація в присутності К, Rb або Cs веде в основному до утворення 4-метилпентен-1, який повільно ізомеризується в 4-метилпентен-2. Димеризація ж у присутності Na призводить до встановлення термодинамічної рівноваги метилпентенів[31].
Олігомеризація ред.
Пропілен, як і інші алкени, вступає в реакцію олігомеризації двома шляхами — термічним (нагрівання до високих температур під тиском) та каталітичним (при м'яких умовах).
Термічна олігомеризація пропілену застосовується в промисловості в процесі олігомеризації крекінг-газу, розробленому фірмами «Pure Oil Со.» і «Alco Products Inc.» (метод Alco)[32]. За методом Alco фракція С3 — С4 нагрівається до 480–540 °С під тиском 50 кгс/см².
Найпоширеніший спосіб каталітичної олігомеризації пропілену полягає в пропусканні його над фосфорною кислотою, нанесеною на кизельгур, активоване вугілля або азбест. Власне сам каталізатор складається із суміші каталітично активних орто- та пірофосфорної кислот. При температурі вище 240–260 °С ці кислоти дегідратують в каталітично неактивну метафосфорну кислоту. Щоб перешкодити дегідратації кислот і тим самим максимально продовжити термін служби каталізатора, потрібно додати до газової суміші 2–10 % водяної пари (найкраще 5%).
Алкілування ред.
Алкілування пропілену відбувається при його взаємодії з парафіновими вуглеводнями. Алкілування можна проводити термічним або каталітичним шляхом.
Промислове значення отримав поки тільки каталітичний метод, при якому застосовуються в основному сірчана кислота і фтороводень, менше — хлористий алюміній.
Термічне алкілування проходить за механізмом радикально-ланцюгової реакції, тому додавання агентів утворення радикалів (наприклад, хлорорганічних сполук) викликає пониження температури реакції з 500 до 400 °С.
Найчастіше пропілен алкілують ізобутаном. Процес проводять при 400 °С під тиском 280–1050 кгс/см² в присутності 1,2,3-трихлорпропану і 1,2-дихлорпропану[33]. У результаті утворюються 2,2-диметилпентан і 2-метилгексан. З підвищенням тиску утворюється більше 2-метилгексану, що свідчить про зменшення відносної швидкості реакції третинного атома вуглецю. Іншими каталізаторами термічного алкілування під тиском є тетраетилсвинець[34] та пероксиди (наприклад, перекис бензоїлу[35], перекис трет-бутилу[36]).
Взаємодія з ароматичними вуглеводнями ред.
Про взаємодію пропілену з ароматичними вуглеводнями часто згадують завдяки одному із важливих методів одержання фенолу — кумольний синтез. За цим методом фенол синтезують із бензену і пропілену через кумол та його гідропероксид.
У промислових умовах пропілен вводиться в реакцію з бензеном за Фріделем—Крафтсом в присутності різних каталізаторів. Ця реакція була вперше описана Беррі[37], який її проводив при 70 °С в присутності AlCl3.
Для промислового синтезу кумолу пропонуються два основних шляхи:
- алкілування в рідкій фазі в присутності AlCl3, H2SO4 або HF;
- алкілування в паровій фазі на твердих каталізаторах фосфорна кислота-кизельгур[38].
Полімеризація ред.
У період з 1950 по 1960 роки в області полімеризаційних процесів із застосуванням спеціально розроблених каталізаторів Ціглера і Натта був відкритий новий розділ, що представляє значний теоретичний і практичний інтерес. Мова йде про стереоспецифічну полімеризацію. Різні стереоізомерні полімери, отримані на основі одного і того ж мономеру в залежності від ходу полімеризації можуть значно відрізнятися за фізичними властивостями.
З пропілену стереоспецифічною полімеризацією в залежності від умов реакції можуть бути отримані наступні продукти:[39][40][41][42]
Стереоспецифічна полімеризація проходить в три етапи:
- ініціювання
- ріст ланцюга
- обрив ланцюга.
Дуже хорошим каталізатором для полімеризації пропілену виявилася система R3Al + TiCl3 — каталізатор, розроблений Ціглером і Натта. У цій системі хлор в TiCl3 — є агентом переносу ланцюга, а гідрид алюмінію (або алкілалюміній) — співкаталізатором.
Диспропорціонування ред.
У 1964 році вперше було встановлено, що пропілен можна диспропорціонувати в етилен і С4-олефіни (поряд з вищими олефінами). Як каталізатор для цієї реакції був взятий просочений Мо(СО)6 або W(CO)6 оксид алюмінію Al2O3, який потім активувався при 540–580 °С. Крім того, ефективними каталізаторами є MoO3 на Al2O3 і активований каталізатор на основі 3,4 % СоО, 11,0 % MoO2 і 85,6 % Al2O3[43][44][45][46].
Надалі метод був розроблений до стадії промислового впровадження. Поряд з каталізаторами на основі молібдену і вольфраму, до яких, крім вищезгаданих, належать також MoS2 і WS, був запропонований каталізатор Re2O7 на Al2O3[47][48][49][50][51]. При використанні цього каталізатора вже при 25 °С і часі контакту 1,8 с конверсія пропілену досягає 34,7 %. При цьому утворюється 11,8 % етилену і ~22,4 % бутену-2, що відповідає селективності 98,5 %. Значно меншою є конверсія при застосуванні як носія SiO2, TiO2, ZrO2, ThO2 або SnO2.
Гідрогенізація ред.
У присутності каталізаторів на основі платини, паладію чи нікелю, а також при підвищеній температурі, пропілен здатен приєднувати водень, утворюючи при цьому насичений вуглеводень пропан за реакцією:
Гідратація ред.
Пропілен взаємодіє з водою за умови підвищених температур у присутності сульфатної чи фосфорної кислоти з утворенням одноатомного спирту — ізопропанолу. Процес можна описати наступним рівнянням реакції:
Приєднання галогеноводнів ред.
Електрофільне приєднання галогеноводнів до алкенів, зокрема і до пропілену, відбувається за правилом Марковникова, тобто галогеноводневі сполуки HHal приєднується до атома вуглецю з найбільшою кількістю атомів водню біля подвійного зв'язку, а залишок Hal відповідно до іншого атому вуглецю біля подвійного зв'язку з меншою кількістю атомів водню.
Окиснення ред.
Горіння на повітрі ред.
При внесенні джерела вогню пропілен горить на повітрі:
Каталітичне окиснення киснем повітря ред.
При нагріванні пропілену на повітрі в присутності срібних каталізаторів відбувається утворення пропіленоксиду за реакцією:
Окиснення перманганатом калію ред.
У слабколужному або нейтральному водному середовищі пропілен окиснюється перманганатом калію. Процес супроводжується знебарвленням розчину KMnO4 і утворенням гліколів — сполук з двома гідроксильними групами при сусідніх атомах вуглецю. Ця реакція одержала назву реакції Вагнера.
Застосування ред.
Одним із головних напрямків використання пропілену є виробництво поліпропілену, яке розпочалося в промислових масштабах з 1954 року завдяки роботам Натта. Поліпропілен дуже широко застосовується в народному господарстві як пластик, а також для виробництва волокна та ін.
Близько 10 % нафтохімічного пропілену витрачається на виробництво оксиду пропілену. Сам же оксид пропілену використовується для синтезу пропіленгліколю, який далі взаємодією з диізоціанатами, подібно до інших багатоатомних спиртів (наприклад, гліцерину) утворюють поліуретани, що в спіненому стані застосовуються як амортизуючі матеріали (килимки, меблі, пакувальна тара), теплоізолятори у будівництві, фільтрувальні і сорбуючі матеріали.
Найважливіше застосування пропілену пов'язане з синтезом ізопропілового спирту та ацетону. Ізопропіловий спирт, який використовується як цінний розчинник, можна вважати першим продуктом нафтохімії. Майже 50 % виробленого ізопропілового спирту витрачається на отримання ацетону.
Ще пропілен використовується для синтезу альдегідів, акрилової кислоти і акрилонітрилу. Для виробництва останнього використовується близько 15 % нафтохімічного пропілену. З акрилонітрилу потім отримують цінне волокно (нітрон), пластичні маси (співполімер із стиреном), синтетичні каучуки (кополімер з бутадієном).
Небезпека використання ред.
Пропілен є горючою речовиною з температурою самозаймання 410 °C і концентраційними межами запалення в суміші з повітрям 2,0–11,1 % (об'ємних). Гранично допустима концентрація (ГДК) становить 30 мг/м³.
Токсичний вплив на тварин ред.
Діє трохи сильніше ніж етилен. Мінімальна наркотична концентрація становить близько 40–50 % в суміші з повітрям або киснем (білі миші і пацюки, коти, собаки). Концентрація 65 % знижує кров'яний тиск у котів, а 70–80 % викликає загибель котів і собак. Такий самий ефект спостерігається і для мишей і пацюків, але вже при 65 %. Двадцятиразова дія на мишей концентрації 35 % протягом 58 днів викликала незначну жирову інфільтрацію печінки. Вдихання 10 мг/л по 6 годин в день протягом 3,5 місяців не позначилось на спонтанній біоелектричній активності мозку, що спостерігалось при вдиханні більш високих концентрацій[52].
Токсичний вплив на людину ред.
Запах відчутний при 0,0173–0,024 мг/л. Концентрація 15 % спричиняє непритомність через 30 хв., 24 % — через 3 хв., 35–40 % — через 20 с.
Див. також ред.
| Вікісховище має мультимедійні дані за темою: Пропілен |
Примітки ред.
- ↑ OECD SIDS Initial Assessment Report for SIAM 16, July 30, 2003, p. 10.
- ↑ Chemical Economics Handbook, SRI Consulting, 2004.
- ↑ Deimann et al., Crells Chemische Annalen, № 2, 195, 310, 430 (1795).
- ↑ Deimann et al., Crells Chemische Annalen, № 2, 200 (1795).
- ↑ Reynolds, Liebigs Ann. Chem., 77, 118 (1851); A. Cahours, Compt. rend. Т., 21, 143–145 (1850).
- ↑ E. O. Curtiss, Chem. and Ind. (Aug.), 18—23 (1953).
- ↑ Petroleum Processing, № 6, 91—93 (1956).
- ↑ F. Martin, E.Weingaertner in Winnacker — Weingaertner "Chemische Technologie — Organische Technologies I, Miinchen, 1952, S. 885.
- ↑ F. Asinger, Chemie und Technologie der Paraffinkohlenwasserstoffe, Berlin, 1956, S. 122.
- ↑ W. Scheer, Feuerungstechnik, 29, 283 (1941).
- ↑ H. A. Skinner, Trans. Faraday Soc., 41, 645–662 (1945).
- ↑ A. Y. Grosse, V. N. Ipatieff, Industrial & Engineering Chemistry, 32, 268–272 (1940).
- ↑ L. Nowakowski, J. Nepter, Przemysl. Chem., 40, 696–698 (1961).
- ↑ Патент США 2184234, 35, 1934.
- ↑ H.H. Storch, J. Am. chem. Soc., 56, 376 (1934), 57, 2601 (1935).
- ↑ C.G. Silcoks, Proc. Roy. Soc., A 233, 465–479 (1956).
- ↑ Патент США 2000964, 1933.
- ↑ Німецький патент 849548, 1938; французький патент 860289; патент США 2327066, 1943.
- ↑ Chem. Eng., 57, № 2, 111 (1950); Petroleum Refiner, 31, № 1, 149 (1952).
- ↑ Німецький патент 877330, 1942.
- ↑ Англійський патент 736875, 1955; патент США 2695315, 1950.
- ↑ Патент США 2811567, 1957.
- ↑ Англійський патент 912974, 1962; D. A. S. 1190928, 1965.
- ↑ Chem. Eng., 68, № 25, 70—71 (1961).
- ↑ Chem. Industrie, 16, 302 (1964).
- ↑ S. А. Miller, Chem. Process Eng., 47, 268 (1966).
- ↑ Д. Я. Мучинский, В. Н. 3лотченко, Ю. Ф. Семенов, Изв. АН ТуркмССР, Сер. физ.-техн., хим. н геол. науки, № 2, 133 (1965).
- ↑ Англійський патент 903014, 1962; англійський патент 932342, 1963.
- ↑ Французький патент 1315324, 1963.
- ↑ Патент США 2986588, 1961.
- ↑ A. W.Shaw et al.; J. Org. Chem., 3286 (1965).
- ↑ М. В. Cook, H. R. Swanson, С. R. Wagner, Refiner, 14, № 11, 506 (1935); Oil Gas J., 34, № 26 , 56 (1935).
- ↑ J. E. Knap, E. W. Comings, H. G. Drickamer, Industrial & Engineering Chemistry, 46, 708 (1954).
- ↑ Голландський патент 60768, 1948.
- ↑ Патент США 2519072, 1950.
- ↑ Патент США 2909581, 1959.
- ↑ Т. М. Berry, E. E. Reid, J. Am. Chem. Soc., 49, 3148 (1927).
- ↑ P. W. Sherwood, Ind. Chemist, 30, 25, 71 (1954); Erdol und Kohle, 7, 23, 156 (1954).
- ↑ G. Nalla, Rubber Plastics Age, 38, 495 (1957).
- ↑ Chemical Engineering Progress, 55, № 6, 16 (1959).
- ↑ W. L. Carrick et al., J. Am. Chem. Soc., 82, 1502 (1960).
- ↑ L. Berti, Chim. e Ind., Milano, 43, 644 (1961).
- ↑ R. L. Banks, G. С. Bailey, Industrial & Engineering Chemistry, Product. Res. Development, 3, 170 (1964).
- ↑ Патент США 3261879, 1966.
- ↑ Niederlande Agency Senternovem 6410487, 1965.
- ↑ Niederlande Agency Senternovem 6400549, 1964.
- ↑ Патент США 3340322, 1967.
- ↑ Niederlande Agency Senternovem 6610196, 1967.
- ↑ Niederlande Agency Senternovem 6511659, 1966.
- ↑ Niederlande Agency Senternovem 6605328, 1966.
- ↑ Niederlande Agency Senternovem 6611840, 1967.
- ↑ Гигиена труда и охрана здоровья рабочих нефтяной и нефтехимической промышленности. Труды Уфимск. НИИ гиг. труда. Т. 4. 1968. С. 100
Джерела ред.
- Опейда Й., Швайка О. Глосарій термінів з хімії. — Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк : Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0.
- Химическая энциклопедия / Под. ред. Кнунянц И. Л. — Москва : Советская энциклопедия, 1988. — Т. 4. (рос.)
- Андреас Ф., Гребе К. Химия и технология пропилена. — Ленинград : Химия, 1973. — 368 с. (рос.)
- Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей / Под. ред. Лазарева Н.В. и Левиной Э. В. — 7. — Ленинград : Химия, 1976. — Т. 1. — 592 с. — 49000 прим. (рос.)
Посилання ред.
- Стаття про пропілен на сайті "Хімік" (рос.) . Архів оригіналу за 22 червня 2013.
- Паспорт безпеки речовини (англ.) . Архів оригіналу за 22 червня 2013.
- Маркетингове дослідження (англ.) .
| Ця стаття належить до добрих статей української Вікіпедії. |