Methylococcus capsulatus
| Methylococcus capsulatus | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
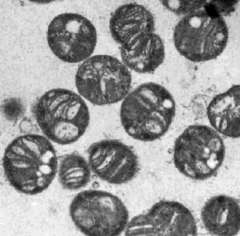 Methylococcus capsulatus, мікрофотографія за допомогою ТЕМ
| ||||||||||||||
| Біологічна класифікація | ||||||||||||||
| ||||||||||||||
| Methylococcus capsulatus Foster et Davis, 1966 | ||||||||||||||
Посилання
| ||||||||||||||
|
Methylococcus capsulatus — облігатно-метанотрофна грам-негативна коковидна бактерія роду Methylococcus, що використовує метан як єдине джерело вуглецю, використання метану інгибуєтся присутністю іонів амонію[1].
Бактерії цього виду здатні також використовувати метанол, формальдегід[2] і мурашину кислоту. Беруть участь в процесі круговороту вуглецю на планеті, використовуючи газоподібний метан для своєї життєдіяльності. Унікальним ферментом, що здійснює першу стадію окислення метану, є метанмонооксигеназа, присутня в клітинах Methylococcus capsulatus в двох формах: розчинній[3] і зв'язаній з мембраною, що складається з трьох субодиниць та містить мідь в активному центрі[4][5]. Здібні до фіксації атмосферного азоту[6], здатні до нітрифікації (за допомогою розчинної і зв'язаною з мембраною метанмонооксигенази, що не має строгої специфічності до субстрату[7][8]) і денітрифікації. Є аеробами і синтезують цитохроми[9][10]. Також бактерії виду здатні синтезувати стероли[11][12].
Геном ред.
Геном Methylococcus capsulatus представлений кільцевою дволанцюжковою молекулою ДНК разміром 3304561 пар основ, що містить 3052 гени, з яких 2956 кодують білки, вміст ГЦ становить 63 %[13]. Геном спеціалізований для метанотрофії і містить генетичну інформацію, що відповідає за невідомі метаболічні шляхи, що імовірно є ключовими в метанотрофії, і гени метанмонооксигеназ, що повторюються[14]. Також з'ясовано, що експресія метанмонооксигенази контролюється іонами міді[15].
Застосування ред.
За рахунок своєї здатності використовувати метан як єдине джерело вуглецю, а також окисляти такі ксенобіотики як трихлоретилен, перспективним є використання Methylococcus capsulatus в біоремедіації, також цей мікроорганізм може використовуватися в мікробіологічному синтезі деяких хімічних речовин і біотрансформації[16].
Посилання ред.
- ↑ Helle N. Carlsen, Lars Joergensen, and Hans Degn (2004). Inhibition by ammonia of methane utilization in Methylococcus capsulatus. Applied Microbiology and Biotechnology. 35 (1): 124—127.[недоступне посилання з листопадаа 2019]
- ↑ Ekundayo K. Adeosun, Thomas J. Smith1, Anne-Mette Hoberg, Giles Velarde, Robert Ford, and Howard Dalton (2004). Formaldehyde dehydrogenase preparations from Methylococcus capsulatus (Bath) comprise methanol dehydrogenase and methylene tetrahydromethanopterin dehydrogenase. Microbiology. 150: 707—713. doi:10.1099/mic.0.26707-0. Архів оригіналу за 7 жовтня 2008. Процитовано 18 січня 2009.
- ↑ David Coufal. Studies of the Soluble Methane Monooxygenase: Heterologous Expression and Reactions with Nitric Oxide (P.D. thesis) (PDF). Архів (PDF) оригіналу за 27 червня 2013. Процитовано 18 січня 2009.
- ↑ Hiep-Hoa T. Nguyen, Sean J. Elliott, John Hon-Kay Yip, and Sunney I. Chan (1998). The Particulate Methane Monooxygenase from Methylococcus capsulatus (Bath) Is a Novel Copper-containing Three-subunit Enzyme. J Biol Chem. 273 (14): 7957—7966. Архів оригіналу за 22 вересня 2008. Процитовано 18 січня 2009.
- ↑ Colby J, Stirling DI, Dalton H. (1977). The soluble methane mono-oxygenase of Methylococcus capsulatus (Bath). Its ability to oxygenate n-alkanes, n-alkenes, ethers, and alicyclic, aromatic and heterocyclic compounds. Biochem J. 165 (2): 395—402. PMID 411486.
- ↑ Murrell J.C., Dalton H. (1983). Nitrogen fixation in obligate methanotrophs. J Gen Microbiol. 129: 3481—3486..
- ↑ Colby J, Stirling DI, Dalton H (1977). The soluble methane mono-oxygenase of Methylococcus capsulatus (Bath). Its ability to oxygenate n-alkanes, n-alkenes, ethers, and alicyclic, aromatic and heterocyclic compounds. Biochem J. 165 (2): 395—402. PMID 411486.
- ↑ Howard Dalton (1977). Ammonia oxidation by the methane oxidising bacterium Methylococcus capsulatus strain bath. Archives of Microbiology. 114 (3). PMID 18650926.[недоступне посилання з листопадаа 2019]
- ↑ Zahn JA, Arciero DM, Hooper AB, Coats JR, DiSpirito AA (1997). Cytochrome c peroxidase from Methylococcus capsulatus Bath. Arch Microbiol. (5): 362—72. PMID 9325424. Архів оригіналу за 10 червня 2015. Процитовано 18 січня 2009.
{{cite journal}}: Проігноровано невідомий параметр|voluem=(довідка) - ↑ Bergmann DJ, Zahn JA, Hooper AB, DiSpirito AA (1998). Cytochrome P460 genes from the methanotroph Methylococcus capsulatus Bath. J Bacteriol. 180 (24): 6440—5. PMID 9851984. Архів оригіналу за 25 липня 2008. Процитовано 18 січня 2009.
- ↑ Lamb DC, Jackson CJ, Warrilow AG, Manning NJ, Kelly DE, Kelly SL (2007). [[https://web.archive.org/web/20081007200528/http://mbe.oxfordjournals.org/cgi/content/abstract/24/8/1714 Архівовано 7 жовтня 2008 у Wayback Machine.]
- ↑ http://www.nature.com/nature/journal/v230/n5294/abs/230473a0.html [Архівовано 30 вересня 2008 у Wayback Machine.] Lanosterol biosynthesis in the prokaryote Methylococcus capsulatus: insight into the evolution of sterol biosynthesis]. Mol Biol Evol. 24 (8): 1714—21. PMID 17567593.
- ↑ Methylococcus capsulatus str. Bath, complete genome. NCBI.
- ↑ Ward N та ін. (2004). Genomic insights into methanotrophy: the complete genome sequence of Methylococcus capsulatus (Bath). PLoS Biol. 2 (10): e303. PMID 15383840.
{{cite journal}}: Явне використання «та ін.» у:|author=(довідка) - ↑ Róbert Csáki (2002). Investigation of the copper-regulated expression of methane monooxygenases in Methylococcus capsulatus (Bath) (PDF). Acta Biologica Szegediensis. 46 (1-2): 31.
{{cite journal}}: Обслуговування CS1: Сторінки з параметром url-status, але без параметра archive-url (посилання) - ↑ Methylococcus capsulatus is a methane-oxidising bacterium that has great potential in bioremediation. EMBL-EB. Архів оригіналу за 27 червня 2013. Процитовано 18 січня 2009.
Ресурси Інтернету ред.
- Methylococcus capsulatus [Архівовано 20 червня 2009 у Wayback Machine.]
- Methylococcus Foster and Davis 1966, genus
- Methylococcus capsulatus Bath Genome Page[недоступне посилання з лютого 2019]
- Genome Project Methylococcus capsulatus str. Bath
| Це незавершена стаття з бактеріології. Ви можете допомогти проєкту, виправивши або дописавши її. |