Менадіон
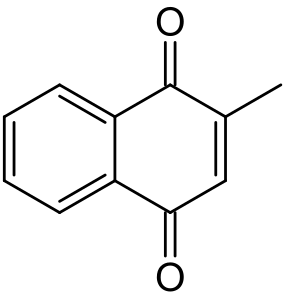
Менадіон (вітамін К3, 2-метил-1,4-нафтохінон) — поліциклічний ароматичний кетон, основою якого є 1,4-нафтохінон. Є провітаміном вітаміну К2.
| Менадіон | |
 | |
| Маса | 2,9E−25 кг[1] |
|---|---|
| Хімічна формула | C₁₁H₈O₂[1] |
| Канонічна формула SMILES | CC1=CC(=O)C2=CC=CC=C2C1=O[1] |
| Температура плавлення | 106 °C[2] |
| Встановлена добова доза | 10 міліграм[3] і 2 міліграм[3] |
| Наявний у таксона | A. indicumd[4], B. alcalophilusd[5], E. coli[6], T. acidophilumd[7], A. stipitatum[8], J. nigra[9], J. regia[9] і стрептоміцети[10] |
| Застосовується для лікування | коагулопатія[11] і hypoprothrombinemiad[11] |
| Код MCN | 2914.69.20 |
| | |
Отримання ред.
З кам'яновугільної смоли виділяють 2-метилнафталін й окиснюють. Також отримується з реакції дієнового синтезу з таких субстратів, як 2-метилфенол й 2-метиланілін[12]. Також отримується шляхом окиснення адукту реакції Дільса-Адлера (між 1,3-бутадієном й 1,4-толуолхініном) у середовищі кисню за температури 150 С.
Він погано розчинний у воді, тому
Біологічна роль ред.
Синтетичне водорозчинне похідне хінонів — вітамін К3 є субстратом DT-діафорази й має властивість шунтувати вільним окисненням початковий та середній сегменти дихального ланцюга. Активація вітаміном К3 або вікасолом дихання, блокованого ротеноном й атиміцином, спряжена із електрон-транспортною функцією на цитохромній ділянці й генерацією (Mokhova et al., 1977). Дослідження енерготропних властивостей вітаміну К показало, що у тканинах, у яких переважає НАД-залежний шлях окиснення (мозок, міокард щурів), вітамін К3 має виражену антигіпоксичну дію[13].
Примітки ред.
- ↑ а б в menadione
- ↑ а б https://www.whocc.no/atc_ddd_index/?code=B02BA02
- ↑ Rohtagi B. K., Gupta R. B., Khanna R. N. Chemical Constituents of Asplenium indicum // J. Nat. Prod. — ACS, 2005. — Vol. 47, Iss. 5. — P. 901–901. — ISSN 0163-3864; 1520-6025 — doi:10.1021/NP50035A032
- ↑ R Meganathan, R Coffell Identity of the quinone in Bacillus alcalophilus. // J. Bacteriol. / T. J. Silhavy — Baltimore: ASM, 2020. — Vol. 164, Iss. 2. — P. 911–913. — ISSN 0021-9193; 1098-5530; 1067-8832 — doi:10.1128/JB.164.2.911-913.1985
- ↑ Emmons G. T., Campbell I. M., R Bentley Vitamin K (menaquinone) biosynthesis in bacteria: purification and probable structure of an intermediate prior to o-succinylbenzoate // Biochem. Biophys. Res. Commun. — Academic Press, Elsevier BV, 1985. — Vol. 131, Iss. 2. — P. 956–960. — ISSN 0006-291X; 1090-2104 — doi:10.1016/0006-291X(85)91332-4
- ↑ Shimada H, Shida Y, Nemoto N et al. Quinone profiles of Thermoplasma acidophilum HO-62. // J. Bacteriol. / T. J. Silhavy — Baltimore: ASM, 2001. — Vol. 183, Iss. 4. — P. 1462–1465. — ISSN 0021-9193; 1098-5530; 1067-8832 — doi:10.1128/JB.183.4.1462-1465.2001
- ↑ O'Donnell G., Poeschl R., Zimhony O. et al. Bioactive pyridine-N-oxide disulfides from Allium stipitatum // J. Nat. Prod. — ACS, 2009. — Vol. 72, Iss. 3. — P. 360–365. — ISSN 0163-3864; 1520-6025 — doi:10.1021/NP800572R
- ↑ а б Binder R. G., Benson M. E., Flath R. A. Eight 1,4-naphthoquinones from Juglans // Phytochemistry — Elsevier BV, 1989. — Vol. 28, Iss. 10. — P. 2799–2801. — ISSN 0031-9422; 1873-3700 — doi:10.1016/S0031-9422(00)98092-0
- ↑ Son S., Ko S., Hong Y. et al. Polyketides and Anthranilic Acid Possessing 6-Deoxy-α-l-talopyranose from a Streptomyces Species // J. Nat. Prod. — ACS, 2017. — Vol. 80, Iss. 5. — P. 1378–1386. — ISSN 0163-3864; 1520-6025 — doi:10.1021/ACS.JNATPROD.6B01059
- ↑ а б NDF-RT
- ↑ Simonova M.V., Zhizhina Ye.G., Matveev K.I., Russkikh V.V. - Vitamin K3 Obtaining by the Diene Synthesis Reaction in Solutions of Ìo–V Phosphoric Heteropoly Acids.
- ↑ Л.Д. Лукьянова - Сигнальные механизмы гипоксии.