Кетони
| Ця стаття містить перелік посилань, але походження тверджень у ній залишається незрозумілим через практично повну відсутність внутрішньотекстових джерел-виносок. (березень 2023) |
Кетонами називаються сполуки, в молекулах яких міститься група атомів >С = О, пов'язана з двома вуглеводневими радикалами.
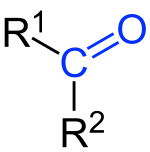
Карбонільна група >С = О присутня в молекулах альдегідів, що зумовлює схожість хімічних властивостей альдегідів і кетонів. Проте схожість не є повною, оскільки в молекулах альдегідів один із зв'язків карбонільною групою витрачається на з'єднання з воднем, а в молекулах кетону обидва зв'язки йдуть на з'єднання з вуглеводневими радикалами. Це позначається, зокрема, на тому, що кетони окиснюються значно важче, ніж альдегіди, і не є такими енергійними відновниками, як альдегіди.
У практичному плані найважливішим з кетонів є диметилкетон, або ацетон.
Представники ред.
| Назва | Формула | Температура плавлення | Температура кипіння |
|---|---|---|---|
| Діметилкетон (ацетон) | CH3COCH3 | −95 °C | 56,1 °C |
| Метилетилкетон (бутанон) | CH3CH2COCH3 | −86 °C | 80 °C |
| Діетилкетон | CH3CH2COCH2CH3 | −40 °C | 102 °C |
| Ацетофенон | 19 °C | 202 °C | |
| Бензофенон | 47,9 °C | 305,4 °C | |
| Циклогексанон | −16,4 °C | 155,65 °C | |
| Діацетил | CH3COCOCH3 | −3 °C | 88 °C |
| Ацетилацетон | CH3COCH2COCH3 | −23 °C | 140 °C |
| Парабензохінон | 115 °C | — |
Реакції ред.
По карбонілу ред.
Кетони беруть участь у багатьох органічних реакціях. Наважливіші реакції - нуклеофільне приєднання до карбонільного атома вуглецю, наприклад:
- З водою дають гемінальні діоли (R2C(OH)2), реакція йде тільки з сильноакцепторними замісниками, наприклад для гексафторацетону. Зі спиртами утворюються кеталі, а з тіолами — тіокеталі.
- З аміаком чи первинними амінами утворюють іміни.
- З вторинними амінами — єнаміни.
- З реактивами Грін'яра та іншими органометалічними сполуками продукти, зо гідролізуються до третинних спиртів
R2C=O + AlkMgCl --> R2AlkCOH .
- З гідразином (N2H4) дають гідразони.
- З гідроксиламіном (NH2OH)) утворюють оксими (R2C=NOH)
Кетонам властива кето-енольна тавтомерія. Зазвичай, кетонна форма набагато стабільніша, але існують винятки.
За іншими позиціями ред.
- Галогенування по α-вуглецю (через енол, монозаміщення в кислому середовищі, полі- — в лужному).
- Галоформна реакція метилкетонів
Див. також ред.
Джерела ред.
- В. І. Саранчук, М. О. Ільяшов, В. В. Ошовський, В. С. Білецький. Хімія і фізика горючих копалин. — Донецьк: Східний видавничий дім, 2008. — с. 600. ISBN 978-966-317-024-4 (С.?)
Посилання ред.
- КЕТОНИ [Архівовано 21 Березня 2016 у Wayback Machine.] //Фармацевтична енциклопедія