Гемоглобінопатія
Гемоглобінопатія — медичний термін для групи спадкових захворювань крові, які в першу чергу впливають на еритроцити[1]. Вони є одногенними захворюваннями і, в більшості випадків, успадковуються як аутосомні кодомінантні ознаки[2].
| Гемоглобінопатія | |
|---|---|
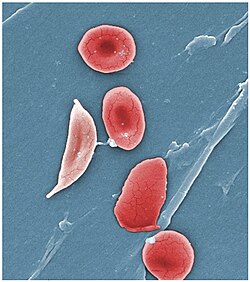 Нормальні еритроцити поруч із серпоподібними при серпоподібноклітинній анемії | |
| Спеціальність | гематологія |
| Симптоми | abnormal hemoglobinsd |
| Класифікація та зовнішні ресурси | |
| МКХ-10 | GroupMajor.minor |
| DiseasesDB | 19674 |
| MeSH | D006453 |
Існує 2 групи гемоглобінопатій: анормальні структурні варіанти гемоглобіну, спричинені мутаціями в його генах, і таласемії, причиною яких є недостатнє вироблення нормальних молекул гемоглобіну. Головними структурними варіантами гемоглобіну є HbS, HbE і HbC. Головними типами таласемії є α-таласемія і β-таласемія[3].
Ці дві групи можуть перетинатися, оскільки деякі стани, які викликають анормальність гемоглобіну, також впливають на їх вироблення. Деякі варіанти гемолгобіну не викликають патології чи анемії, а тому часто не класифікуються як гемоглобінопатії[4][5].
Класифікація гемоглобінопатій ред.
Якісна ред.
Структурні анормальності ред.
Варіанти гемоглобіну: структурні варіанти гемоглобіну є якісними дефектами, які спричиняють зміну в структурі (первинній, вторинній, третинній і/або четвертинній) молекул гемоглобіну. Більшість варіантів гемоглобіну не спричиняють хвороб і найчастіше виявляються випадково або під час скринінгу новонароджених. Підмножина варіантів, які спричиняють важкі хвороби є гомозиготними або складними гетерозиготними станами в поєднанні з іншими структурними варіантами або таласемійними мутаціями. Коли з'являються клінічні наслідки, вони можуть включати анемію внаслідок гемолізу або поліцитемію внаслідок змін спорідненості аномального гемоглобіну до кисню. Поширеними прикладами варіантів гемоглобіну, пов'язаних із гемолізом включають серпоподібний гемоглобін (гемоглобін S) і гемоглобін C. Варіанти гемоглобіну зазвичай можна виявити за допомогою методів аналізу на основі білка; однак для варіантів із неоднозначними або незвичними результатами аналізу білка можуть знадобитися методи на основі ДНК[джерело?].
Основні функціональні наслідки структурних варіантів гемоглобіну можна класифікувати наступним чином:[джерело?]
- Зміна фізичних властивостей (розчинність): поширені мутації бета-глобіну можуть змінити розчинність молекули гемоглобіну: Гемоглобін S полімеризується при деоксигенації, а гемоглобін C кристалізується[6].
- Знижена стабільність білка (нестабільність): нестабільні варіанти гемоглобіну є мутаціями, які спричиняють випадіння молекули в осад, раптово або під окислювальним стресом, призводячи до гемолітичної анемії. Випадаючи в осад, денатурований гемоглобін може прикріплюватися до внутришнього шару плазматичної мембрани еритроцитів і утворювати тільця Гейнца[7].
- Зміна спорідненості до кисню: висока або низька киснева спорідненість молекул гемоглобіну частіше, ніж молекули з нормальною, перебувають у розслабленому (R, оксигенованому) стані або наспруженому (T, деоксигенованому) стані відповіндо. Варіанти з високою спорідненістю (R стан) спричиняють поліцитимію (наприклад, гемоглобін Chesapeake або Montefiore), а варіанти з низькою можуть спричиняти ціаноз (наприклад, гемоглобін Kansas або Beth Israel)[8].
- Окиснення заліза в гемі: мутації місця зв'язування гема, особливо ті, що впливають на збережені проксимальні або дистальні залишки гістидину, можуть утворювати метгемоглобін, у якому атом заліза в гемі окислюється з двовалентного стану (Fe2+) у тривалентний (Fe3+), призводячи до метгемоглобінемії[8].
Хімічні анормальності ред.
- Метгемоглобінемія:
- стан, викликаний підвищеним рівнем метгемоглобіну в крові. Метгемоглобін — форма гемоглобіну, яка містіть тривалентний [Fe3+] атом заліза. Спорідненість тривалентного заліза до кисню порушується. Прив'язування оксигену до метгемоглобіну призводить до підвищеної спорідненості з оксигеном у решті місць гему, які перебувають у двовалентному стані в межах однієї тетрамерної одиниці гемоглобіну[джерело?].
Кількісна ред.
Вироблення анормальностей ред.
Варіації кількості копій (наприклад, делеції, дуплікації, вставки) також є поширеною генетичною причиною гемоглобінопатій. Також можуть відбуватися складні перебудови та злиття генів глобіну[джерело?].
- Таласемії: таласемії — це кількісні дефекти, які призводять до зниження рівня одного типу ланцюга глобіну, створюючи дисбаланс у співвідношенні альфа-подібних ланцюгів до бета-подібних ланцюгів. Як зазначалося вище, це співвідношення зазвичай жорстко регулюється, щоб запобігти накопиченню надлишкових ланцюгів глобіну одного типу. Надлишок ланцюгів, які не входять до гемоглобіну, утворюють нефункціональні агрегати, які осідають в еритроцитах. Це може призвести до передчасного руйнування еритроцитів у кістковому мозку (бета-таласемія) та/або в периферичній крові (альфа-таласемія). Типи:
Еволюція ред.
Деякі гемоглобінопатії (а також деякі пов'язані захворювання, такі як дефіцит глюкоза-6-фосфатдегідрогенази) здається, дали еволюційну користь, зокрема гетерозиготам, у місцях, де поширена малярія. Паразити малярії живуть усередині еритроцитів, але незначно порушують нормальну функцію клітин. У пацієнтів, схильних до швидкого очищення еритроцитів, це може призвести до раннього руйнування клітин, інфікованих паразитом, і збільшення шансів на виживання для носія ознаки[джерело?].
Функції гемоглобіну:
- Транспортування кисню від легенів до тканин: це пов’язано зі специфічною взаємодією глобінових ланцюгів, що дозволяє молекулі приймати більше кисню там, де його більше, і вивільняти кисень при низькій концентрації кисню.
- Транспортування вуглекислого газу від тканин до легенів: кінцевим продуктом метаболізму тканин є кислота, яка збільшує кількість іонів водню в розчині. Іони водню поєднуються з гідрокарбонатами, утворюючи воду та вуглекислий газ. Вуглекислий газ поглинається гемоглобіном, щоб сприяти цій оборотній реакції.
- Транспорт оксиду азоту(II): оксид азоту є судинорозширювальним засобом. Це допомагає регулювати реакцію судин під час стресу, наприклад під час запалення.
Примітки ред.
- ↑ CDC (8 лютого 2019). Hemoglobinopathies Research. Centers for Disease Control and Prevention. Процитовано 5 травня 2019.
- ↑ Weatherall DJ, Clegg JB. Inherited haemoglobin disorders: an increasing global health problem. Bull World Health Organ. 2001;79(8):704-712.
- ↑ Hemoglobinopathies and Thalassemia. medicalassistantonlineprograms.org/. Архів оригіналу за 9 січня 2015. Процитовано 3 липня 2022.
- ↑ Hemoglobin Variants. Lab Tests Online. American Association for Clinical Chemistry. 10 листопада 2007. Процитовано 12 жовтня 2008.
- ↑ Huisman THJ (1996). A Syllabus of Human Hemoglobin Variants. Globin Gene Server. Pennsylvania State University. Процитовано 12 жовтня 2008.
- ↑ Eaton, William A.; Hofrichter, James (1990). Sickle Cell Hemoglobin Polymerization. Advances in Protein Chemistry. 40: 63—279. doi:10.1016/S0065-3233(08)60287-9. ISBN 9780120342402. PMID 2195851.
- ↑ Srivastava P, Kaeda J, Roper D, Vulliamy T, Buckley M, Luzzatto L. Severe hemolytic anemia associated with the homozygous state for an unstable hemoglobin variant (Hb Bushwick). Blood. 1995Sep1;86(5):1977–82.
- ↑ а б Percy MJ, Butt NN, Crotty GM, Drummond MW, Harrison C, Jones GL, et al. Identification of high oxygen affinity hemoglobin variants in the investigation of patients with erythrocytosis. Haematologica. 2009Sep1;94(9):1321–2.
Посилання ред.
| Класифікація | |
|---|---|
| Зовнішні ресурси |